题目内容
18.在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a b c比较大小)(1)同体积、同物质的量浓度的三种酸,中和KOH的能力由大到小的顺序是b>a=c.
(2)若三者pH相同时,酸物质的物质的量浓度由大到小的顺序为c>a>b.
(3)等浓度的三种酸,水电离出H+的浓度的大小关系c>a>b.
(4)pH=2的盐酸和醋酸加水稀释至pH=5,消耗水的体积a<c.
(5)1mol/L的盐酸和醋酸加水稀释这pH=5,消耗水的体积a>c.
分析 (1)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸;
(2)相同浓度时电离产生的氢离子浓度越大,所需的物质的量浓度最小;
(3)酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大;
(4)醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而盐酸是强电解质,不存在电离平衡;
(5)醋酸是弱电解质,而盐酸是强电解质,加水稀释醋酸电离平衡正向移动,盐酸则不存在电离平衡.
解答 解:(1)同体积同物质的量浓度的三种酸,醋酸和盐酸的物质的量相等,但硫酸为二元酸,则中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是b>a=c,
故答案为:b>a=c;
(2)相同浓度时电离产生的氢离子浓度越大,所需的物质的量浓度最小,所以物质的量浓度最小的是H2SO4(硫酸),最大的是醋酸,故答案为:c>a>b;
(3)酸或碱抑制水电离,酸中氢离子浓度越大其抑制水电离程度越大,相同浓度的这三种酸,氢离子浓度大小顺序:b>a>c,则水的电离程度c>a>b,故水电离出H+的浓度c>a>b,故答案为:c>a>b;
(4)设盐酸和醋酸溶液分别加水稀释n倍和m倍后pH相同,因为醋酸是弱酸,加水后反应正向进行,氢离子物质的量增大,加水后,氢离子浓度在减小的过程中有增大的趋势,而盐酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,所以要使稀释后两溶液pH值相同,就必须使m>n,所以所得醋酸溶液的体积大,
故答案为:a<c;
(5)浓度相同的盐酸和醋酸,盐酸中氢离子的浓度大,醋酸中氢离子的浓度小,加水稀释盐酸中氢离子浓度变化小,醋酸中氢离子浓度变化大,所以盐酸加水量大,故答案为:a>c.
点评 本题考查弱电解质的电离,为高频考点,注意强弱电解质的比较和影响反应速率的因素,注重基础知识的积累.

 名校课堂系列答案
名校课堂系列答案| A. | 2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O | |
| B. | CH3COOH+KHCO3→CH3COOK+CO2↑+H2O | |
| C. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O | |
| D. | CH3COOH+Na2CO3→CH3COONa+NaHCO3 |
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 由乙烯、乙炔的结构特点可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
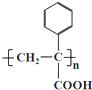
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(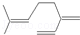 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )
海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )| A. | 共生藻类消耗CO2,有利于珊瑚的形成 | |
| B. | 海洋中CO2浓度升高,抑制了珊瑚的形成 | |
| C. | 温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成 | |
| D. | 将CO2转化为甲醇等化工原料,有助于缓解温室效应 |
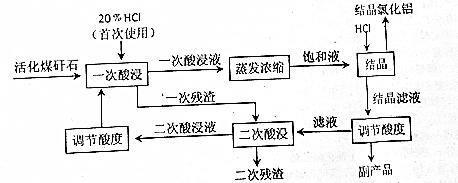
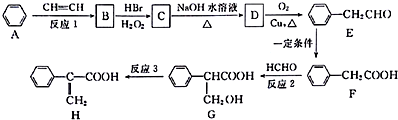
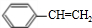 .
.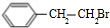 ;②D-E的化学方程式是2
;②D-E的化学方程式是2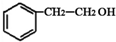 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2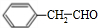 +2H2O;
+2H2O;