题目内容
20.几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )| 元素符号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 离子半径大小:r(X2+)>r(Q2-) | |
| B. | Y与Q形成的化合物不能跟氢氧化钠溶液反应 | |
| C. | M元素与L元素形成的一种化合物是常见的有机溶剂 | |
| D. | Z的单质可在氧气中燃烧生成ZO3 |
分析 均为短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为Cl;M有+4、-4价,处于IVA族,原子半径小于氯的,则M为碳元素;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al;X有+2价,处于ⅡA族,原子半径X>Al,则X为Mg,结合元素周期律及物质的结构与性质解答.
解答 解:均为短周期元素,由元素的化合价可知,Q只有-2价,Z有+6、-2价,则Q为O元素、Z为S元素;L有+7、-1价,则L为Cl;M有+4、-4价,处于IVA族,原子半径小于氯的,则M为碳元素;Y为+3价,处于ⅢA族,原子半径大于硫,所以Y为Al;X有+2价,处于ⅡA族,原子半径X>Al,则X为Mg.
A.Mg2+、O2-离子电子层结构相同,核电荷数越大离子半径越小,故离子半径r(Mg2+)<r(O2-),故A错误;
B.Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;
C.M元素与L元素形成的化合物CCl4是常见的有机溶剂,故C正确;
D.硫单质在氧气中燃烧生成SO2,故D错误.
故选C.
点评 本题考查元素的性质与位置关系,根据原子半径及化合价来推断出元素是解答关键,熟悉元素单质化合物的性质.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
10.如图为原电池示意图,下列说法中正确的是( )


| A. | 锌片是正极 | B. | 铜片是负极 | ||
| C. | 该装置能够将电能转化为化学能 | D. | 电子由锌片通过导线流向铜片 |
8.下列说法正确的是( )
| A. | 某溶液$\stackrel{+硝酸银溶液}{→}$生产白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+氯化钡溶液}{→}$生产白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液$\stackrel{+稀硫酸}{→}$生成无色气体,说明原溶液中有CO32- | |
| D. | 某溶液$\stackrel{+氢氧化钠溶液}{→}$生产蓝色沉淀,说明原溶液中有Cu2+ |
15.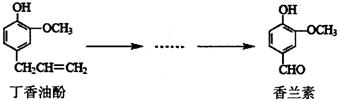 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
 香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香油酚多步反应合成.有关上述两种化合物的说法正确的是( )| A. | 在丁香油酚分子中至少有12个原子共平面 | |
| B. | 常温下,1mol丁香油酚可与2molBr2反应 | |
| C. | 1moI香兰素最多能与4mol氢气发生加成反应 | |
| D. | 可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
5.Al、Fe都是重要的金属元素.下列说法正确的是( )
| A. | 两者对应的氧化物均为碱性氧化物 | |
| B. | 两者的单质都不能与氢氧化钠溶液反应 | |
| C. | 常温条件下,两种金属都能溶解于浓硫酸中 | |
| D. | 制备AlCl3、FeCl3,均不能采用将其溶液直接蒸干的方法 |
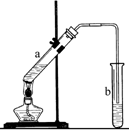
12.实验室模拟合成 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.
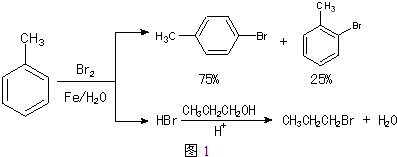
已知:甲苯和液溴在有少量水存在时也能反应(如图2):
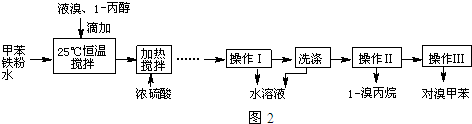
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入水(或H2O或蒸馏水),以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式 .
.
(2)反应装置如图3所示:
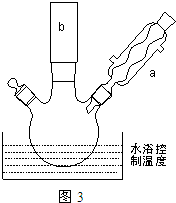 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收反应生成的HBr气体.加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是催化剂.
(3)操作I的名称是分液,操作Ⅲ的名称是蒸馏.
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00mL,用0.1000mol•L-1 NaOH溶液滴定,以测定溶液pH.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点.
 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.
已知:甲苯和液溴在有少量水存在时也能反应(如图2):

实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如表:
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
 .
.(2)反应装置如图3所示:
 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收反应生成的HBr气体.加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是催化剂.
(3)操作I的名称是分液,操作Ⅲ的名称是蒸馏.
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00mL,用0.1000mol•L-1 NaOH溶液滴定,以测定溶液pH.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点.
10.在元素R的原子中,最外层上的电子数比次外层上的电子数多2个,则R不能形成的化台物是( )
| A. | RO | B. | R2H4 | C. | HRO2 | D. | H2R2O4 |
 有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为
有A、B、C、D四种有机物,A、B、C都属于烃类物质,D是烃的衍生物.A是含氢量最大的有机物,分子结构为正四面体;B的球棍模型为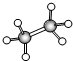 ;C的比例模型为
;C的比例模型为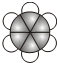 ;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应.
;D的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.