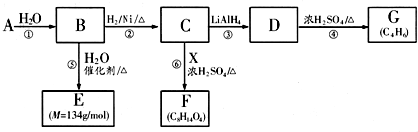
题目内容
配平下列氧化还原反应的化学方程式:
(1) FeS+ KMnO4+ H2SO4→ K2SO4+ MnSO4+ H2O+ Fe2(SO4)3
(2) HCl(浓)+ K2Cr2O7△ CrCl3+ KCl+ Cl2+ H2O.
(1)
(2)
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)反应中铁从+2升为+3价,硫从-2升为+6价,2个FeS共升高18价,锰元素化合价从+7降为+2,共降低5价,化合价升降最小公倍数为90,故FeS系数为10,高锰酸钾系数为18,MnSO4系数为18,Fe2(SO4)3系数为5,再根据元素守恒确定其它物质的系数,配平方程式;
(2)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,再根据元素守恒确定其它物质的系数,配平方程式.
(2)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,再根据元素守恒确定其它物质的系数,配平方程式.
解答:
解:(1)反应中铁从+2升为+3价,硫从-2升为+6价,2个FeS共升高18价,锰元素化合价从+7降为+2,共降低5价,化合价升降最小公倍数为90,故FeS系数为10,高锰酸钾系数为18,MnSO4系数为18,Fe2(SO4)3系数为5,根据K元素守恒可知K2SO4系数为9,根据S元素守恒可知H2SO4系数为32,根据H元素可知H2O的系数为32,故答案为:10、18、32、9、18、32、5;
(2)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为14,根据H元素可知H2O的系数为7,故答案为:14、1、2、2、3、7.
(2)反应中氯从-1升为0价,2个氯离子共升高2价,铬元素化合价从+6降为+3,两个铬共降低6价,化合价升降最小公倍数为6,故K2Cr2O系数为1,CrCl3系数为2,Cl2系数为3,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为14,根据H元素可知H2O的系数为7,故答案为:14、1、2、2、3、7.
点评:本题考查氧化还原反应配平,难度中等,根据化合价升降和原子守恒配平,注意掌握在该反应(2)中HCl部分被氧化.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目均为0.1NA |
| B、精炼铜过程中阳极减轻6.4g时,电路中转移电子数等于0.2NA |
| C、2gD216O中含中子、质子、电子数目均为NA |
| D、标准状况下,11.2L NO和O2的混合气体所含有的分子数为0.5 NA |
对于反应①KHCO3溶液与石灰水反应;②Na2CO3 溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是( )
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
用0.100mol?L-1的盐酸滴定10ml 0.100mol?L-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05mol?L-1 NaHCO3的pH约为8.3,下列说法不正确的是( )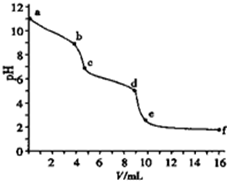

| A、以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3 |
| B、以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml |
| C、溶液pH=7(c点),碳酸钠完全转化为NaCl |
| D、ce段对应溶液中CO2与NaHCO3共存 |
从铝土矿制备铝所涉及的反应中,不属于离子反应的是( )
| A、铝土矿溶于NaOH溶液中 |
| B、NaAlO2溶液的酸化 |
| C、灼烧氢氧化铝固体 |
| D、电解熔融的氧化铝 |
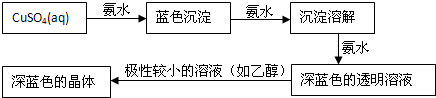
 运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义.
运用化学反应原理研究碳、氮的单质及其化合物的反应具有重要意义. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: