题目内容
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式:
(2)饱和碳酸钠溶液的主要作用是
(3)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
考点:乙酸乙酯的制取
专题:实验题
分析:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、吸收乙醇,同时降低乙酸乙酯的溶解度,便于分层;
(3)分离互不相溶的液体,可用分液的方法分离.
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、吸收乙醇,同时降低乙酸乙酯的溶解度,便于分层;
(3)分离互不相溶的液体,可用分液的方法分离.
解答:
解:(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,化学方程式为CH3COOH+C2H5OH
CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:除去挥发出来的乙醇和乙酸,降低乙酸乙酯的溶解度;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液.
| 浓H2SO4 |
| △ |
故答案为:CH3COOH+C2H5OH
| 浓H2SO4 |
| △ |
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:除去挥发出来的乙醇和乙酸,降低乙酸乙酯的溶解度;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液.
点评:本题考查乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大.

练习册系列答案
相关题目
美国康乃尔大学的魏考克斯(C.Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子,有关该有机分子的说法正确的是( )
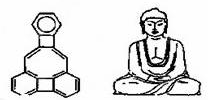

| A、该有机物所有原子一定在同一平面 |
| B、该有机物属于苯的同系物 |
| C、该有机物分子中含有21个碳原子 |
| D、该有机物一氯代物只有4种 |
向硫酸铝溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是( )
| A、NaOH |
| B、NH3?H2O |
| C、NaCl |
| D、MgCl2 |
下列关于原子结构、元素性质及元素周期表的结构的说法正确的是( )
| A、元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
| B、短周期元素中,元素符号用一个大写英文字母表示的元素共有7种 |
| C、第三周期元素的最高正化合价等于它所处的主族序数 |
| D、共价化合物中各原子都一定满足最外层8电子稳定结构 |