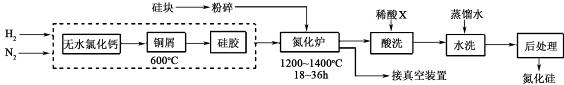
题目内容
19.已知1molX2完全燃烧生成X2O放出热量a kJ.且氧气中1molO=O键完全断裂时吸收热量b kJ,X2O中1molX-O键形成时放出热量c kJ,X2中1molX-X键断裂时吸收热量为( )| A. | 4c-b+2a kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
分析 2X2+O2$\frac{\underline{\;点燃\;}}{\;}$2X2O,1molX2O含有2molX-O键,1molX2中1mol X-X键,根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:已知1molX2完全燃烧生成X2O放出热量a kJ,可知2molX2完全燃烧生成X2O时放出热量2akJ,X2完全燃烧生成X2O是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molX-X键断裂时吸收热量为x,根据方程式:2X2+O2$\frac{\underline{\;点燃\;}}{\;}$2X2O,则:2akJ=ckJ×4-(2x+bkJ),解得x=$\frac{(4c-b-2a)}{2}$kJ,
故选B.
点评 本题考查学生化学反应中的能量变化知识,熟记放出的热量=新键生成释放的能量-旧键断裂吸收的能量是解题的关键,难度不大.

练习册系列答案
相关题目
9.氨水的成分很复杂,下列有关氨气及氨水的说法中正确的是( )
| A. | 氨水属于化合物 | |
| B. | 一水合氨属于电解质 | |
| C. | 氨气溶于水时,只有极少数氨气与水结合生成一水合氨 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
20.(1)下列化学用语均有错误,请将正确的化学用语填在相应的横线上
氯元素CLCl2个氮分子2N2N2铁离子 ${\;}_{Fe}^{+2}$+2价铁元素
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
氯元素CLCl2个氮分子2N2N2铁离子 ${\;}_{Fe}^{+2}$+2价铁元素
(2)填表:(类别选填“单质”、“氧化物”、“酸”、“碱”、“盐:
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
1.在无色溶液中能大量共存的一组离子是( )
| A. | Na+、CH3COO-、CO32-、OH- | B. | K+、Al3+、SO42-、AlO2- | ||
| C. | Na+、K+、SO32-、Fe3+ | D. | NH4+、H+、NO3-、HCO3- |
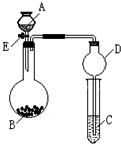 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题: