题目内容
运用所学知识,解决下列惩题:
(1)合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.
已知:

1mol N-H键断裂吸收的能量为 kJ.
(2)工业上用NH3和CO2原料合成尿素的化学方程式为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)
,该反应的平衡常数和温度关系如下表:
①该反应的正反应是 反应(填“放热”或“吸热”).
②在一定条件下,原料气中的氨碳比[n(NH3):n(CO2)]与CO2.平衡转化率的关系如图1,请解释曲线变化趋势的原因 .
③图1中B处NH3的平衡转化率为 .
(3)氨可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,则氨燃料电池的负极电极反应为 .

(4)人工肾脏用间接电化学方法除去代谢产物中的尿素,原理如图2:
①电源的正极为 (填“A“或“B“).
②阳极室中发生的反应依次为 、 .
③邀鳃结束震,蘸极室溶液的pH与电解前相比将 (填“增大”、“减小”或“不变”);若两极挟收集到气体8.961(标准状况),则除去的尿素为 g(忽略气体的溶解).
(1)合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.
已知:

1mol N-H键断裂吸收的能量为
(2)工业上用NH3和CO2原料合成尿素的化学方程式为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)
,该反应的平衡常数和温度关系如下表:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定条件下,原料气中的氨碳比[n(NH3):n(CO2)]与CO2.平衡转化率的关系如图1,请解释曲线变化趋势的原因
③图1中B处NH3的平衡转化率为
(3)氨可用作碱性燃料电池的燃料,电池反应为4NH3+3O2═2N2+6H2O,则氨燃料电池的负极电极反应为

(4)人工肾脏用间接电化学方法除去代谢产物中的尿素,原理如图2:
①电源的正极为
②阳极室中发生的反应依次为
③邀鳃结束震,蘸极室溶液的pH与电解前相比将
考点:有关反应热的计算,化学电源新型电池,化学平衡常数的含义,化学平衡的计算,电解原理
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)化学反应旧键断裂吸收能量,新键生成释放能量,反应焓变的数值是两者能量的差值;
(2)①温度对反应平衡常数的影响和反应的吸放热之间有关;
②增加反应物的量,化学平衡正向移动,能使另一种反应物的转化率增大;
③依据化学平衡三段式列式计算得到;
(3)在燃料点池中,负极上是燃料发生失电子的氧化反应;
(4)①电解池的阴极连接电源的负极,阳极连接电源的正极,根据电解产物判断;
②阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③根据电极方程式计算,有关反应有为阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
(2)①温度对反应平衡常数的影响和反应的吸放热之间有关;
②增加反应物的量,化学平衡正向移动,能使另一种反应物的转化率增大;
③依据化学平衡三段式列式计算得到;
(3)在燃料点池中,负极上是燃料发生失电子的氧化反应;
(4)①电解池的阴极连接电源的负极,阳极连接电源的正极,根据电解产物判断;
②阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③根据电极方程式计算,有关反应有为阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
解答:
解:(1)反应热等于反应物的总键能减去生成物的总键能,根据N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1,令N-H键能为 xKJ/mol,则945.8kJ/mol+3×436kJmol-6xkJ/mol=-92.2kJ/mol解得x=391,故答案为:391;
(2)①该反应的K随着温度的升高而减小,所以该反应是放热的,故答案为:放热;
②氨碳比增大,即NH3的物质的量增大,会使得尿素合成反应的平衡向正向移动,所以使CO2的转化率增大,故答案为:碳比增大,n(NH3)增大,尿素合成反应的平衡向正向移动,使CO2的转化率增大;
③B点处二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率=
×100%=32% 故答案为:32%;
(3)氨可用作碱性燃料电池的燃料,根据电池反应:4NH3+3O2═2N2+6H2O,氨燃料电池的负极上是燃料氨气发生失电子的氧化反应,其电极反应2NH3-6e-+6OH-=N2+6H2,故答案为:2NH3-6e-+6OH-=N2+6H2;
(4)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,故答案为:A;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44 L气体中,V(N2)=V(CO2)=
=1.7922LL,即n(N2)=n(CO2)=0.08 mol,根据方程式CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知生成0.08mol N2所消耗的CO(NH2)2的物质的量也为0.08 mol,其质量为:m[CO(NH2)2]=0.08 mol×60 g?mol-1=4.8g,
故答案为:不变;4.8.
(2)①该反应的K随着温度的升高而减小,所以该反应是放热的,故答案为:放热;
②氨碳比增大,即NH3的物质的量增大,会使得尿素合成反应的平衡向正向移动,所以使CO2的转化率增大,故答案为:碳比增大,n(NH3)增大,尿素合成反应的平衡向正向移动,使CO2的转化率增大;
③B点处二氧化碳转化率为64%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.64mol,
依据化学方程式2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)反应的氨气为1.28mol,
NH3的平衡转化率=
| 1.28mol |
| 4mol |
(3)氨可用作碱性燃料电池的燃料,根据电池反应:4NH3+3O2═2N2+6H2O,氨燃料电池的负极上是燃料氨气发生失电子的氧化反应,其电极反应2NH3-6e-+6OH-=N2+6H2,故答案为:2NH3-6e-+6OH-=N2+6H2;
(4)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律及本题图中的电极产物H2和Cl2,可以判断出A为电源的正极,B为电源的负极,故答案为:A;
②阳极首先发生氧化反应生成氯气,氯气和尿素反应生成氮气、二氧化碳和氯化氢,阳极室中发生的反应依次为:2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,
故答案为:2Cl--2e-=Cl2↑;CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl;
③阴极反应为:6H2O+6e-=6OH-+3H2↑(或6H++6e-=3H2↑)阳极反应为:6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl.
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44 L气体中,V(N2)=V(CO2)=
| 8.961L |
| 5 |
故答案为:不变;4.8.
点评:本题综合考查学生热化学、电化学以及化学反应速率和平衡的综合知识,注意知识的迁移和应用是关键,难度大.

练习册系列答案
相关题目
在1L 1mol/L氨水中,下列叙述正确的是( )
| A、含1mol NH3?H2O |
| B、含NH3、NH4+之和为1mol |
| C、只含有1mol NH3 |
| D、NH3、NH3?H2O、NH4+之和为1mol |
下列离子方程式书写正确的是( )
| A、向AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、往CaCl2溶液通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
| C、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| D、向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-═BaSO3↓+H2O |
下列各图示实验设计和操作合理的是( )
A、 证明非金属性强弱:S>C>Si |
B、 制备少量氧气 |
C、 配制一定物质的量浓度的硫酸溶液 |
D、 制备少量乙酸丁酯 |
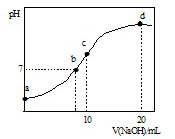 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |

 (或写成
(或写成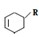 R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
R代表取代基或氢);Ⅱ.甲为烃;Ⅲ.F能与NaHCO3反应产生CO2;请完成以下问题:
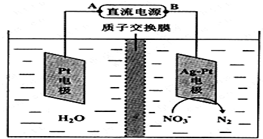 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染.电化学降解NO3-的原理如图所示.