题目内容
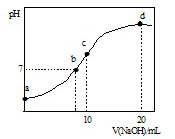 常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )
常温下,向20.00mL 0.1000mol?L-1 (NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如右图所示(不考虑挥发).下列说法正确的是 ( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.a点溶液中的溶质为(NH4)2SO4,硫酸铵为强酸弱碱盐,溶液呈酸性;
B.b点溶液呈中性,则c(H+)=c(OH-),溶液中的溶质是硫酸铵、硫酸钠和一水合氨;
C.c点溶液中的溶质是硫酸钠、一水合氨;
D.d点溶液中的溶质是硫酸钠、一水合氨和NaOH,溶液呈碱性.
B.b点溶液呈中性,则c(H+)=c(OH-),溶液中的溶质是硫酸铵、硫酸钠和一水合氨;
C.c点溶液中的溶质是硫酸钠、一水合氨;
D.d点溶液中的溶质是硫酸钠、一水合氨和NaOH,溶液呈碱性.
解答:
解:A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42-),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3?H2O)=2c(SO42-)=2c(Na+),所以得c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-),故C正确;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3?H2O )>c(SO42-),故D错误;
故选C.
B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3?H2O)=2c(SO42-)=2c(Na+),所以得c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-),故C正确;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3?H2O )>c(SO42-),故D错误;
故选C.
点评:本题考查了离子浓度大小比较,明确曲线上每一点的溶质及其性质是解本题关键,再结合物料守恒、电荷守恒来分析解答,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
根据如图实验装置判断,下列说法正确的是( )


| A、该装置能将电能转化为化学能 |
| B、活性炭为正极,其电极反应式为:2H++2e-═H2↑ |
| C、电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D、装置内总反应方程式为:4Al+3O2+6H2O═4Al(OH)3 |
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| A、MgSO4,CuSO4 |
| B、AgNO3,Pb(NO3)2 |
| C、FeSO4,Al2 (SO4)3 |
| D、CuSO4,AgNO3 |
某化学兴趣小组学习原电池知识后,决定用其原理,尝试利用铁粉、活性炭、无机盐等物质开发产品.小组提出的设想或对原理的理解不正确的是( )
| A、打算制成小包装用于糕点的脱氧剂 |
| B、利用反应放出热量的原理制成暖宝宝 |
| C、调整电池结构,可降低温度,可用于延长糕点保质期 |
| D、正极的电极反应为:2H2O+O2+4e-=4OH- |




 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: