题目内容
在1L 1mol/L氨水中,下列叙述正确的是( )
| A、含1mol NH3?H2O |
| B、含NH3、NH4+之和为1mol |
| C、只含有1mol NH3 |
| D、NH3、NH3?H2O、NH4+之和为1mol |
考点:弱电解质在水溶液中的电离平衡,氨的化学性质
专题:氮族元素
分析:氨水中的溶质是一水合氨,一水合氨是弱电解质,在水溶液里部分电离,溶液中存在物料守恒.
解答:
解:A.一水合氨是弱电解质,在水溶液里部分电离,所以 NH3?H2O的物质的量小于1mol,故A错误;
B.溶液中存在物料守恒,根据物料守恒知,NH3、NH3?H2O、NH4+之和为1mol,故B错误;
C.溶液中部分氨气和水反应生成一水合氨,所以溶液中NH3的物质的量不是1mol,故C错误;
D.溶液中存在物料守恒,根据物料守恒知,NH3、NH3?H2O、NH4+之和为1mol,故D正确;
故选D.
B.溶液中存在物料守恒,根据物料守恒知,NH3、NH3?H2O、NH4+之和为1mol,故B错误;
C.溶液中部分氨气和水反应生成一水合氨,所以溶液中NH3的物质的量不是1mol,故C错误;
D.溶液中存在物料守恒,根据物料守恒知,NH3、NH3?H2O、NH4+之和为1mol,故D正确;
故选D.
点评:本题以氨水为载体考查了弱电解质的电离,根据溶液中的溶质及其性质来分析解答,注意氨水的溶质是一水合氨,不是氨气,为易错点.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
根据如图实验装置判断,下列说法正确的是( )


| A、该装置能将电能转化为化学能 |
| B、活性炭为正极,其电极反应式为:2H++2e-═H2↑ |
| C、电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔 |
| D、装置内总反应方程式为:4Al+3O2+6H2O═4Al(OH)3 |
下列有关同分异构体数目的叙述不正确的是( )
| A、若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 |
B、与 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 |
| C、含有5个碳原子的饱和链烃,其一氯取代物共有8种 |
D、菲的结构简式为 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是( )
| A、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ |
| B、小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
| C、“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O═CO32-+2HClO |
| D、在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O═2Fe3++Cl-+2OH- |
如图实验装置或操作能达到目的是( )
A、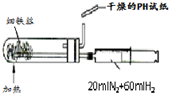 合成氨并检验氨的生成 |
B、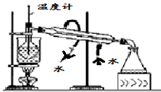 碘的CCl4溶液中分离I2并回收CCl4 |
C、 分离CH3CH2OH和CH3COOC2H5混合液 |
D、 制备Fe(OH)2 |





