题目内容
8.下列物质反应以后,固体物质的质量减轻的是( )| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |
分析 A.氢气通过灼热的CuO粉末,固体CuO→Cu,质量减轻;
B.2Na2O2+2CO2=2Na2CO3+O2↑,固体增重2CO;
C.铝与Fe2O3发生铝热反应,2Al+Fe2O3$\frac{\underline{\;加热\;}}{\;}$Al2O3+2Fe,固体质量不变;
D.将铁钉投入Cu(NO3)2溶液,Fe+Cu(NO3)2=Fe(NO3)2+Cu,析出的Cu附着在铁钉表面.
解答 解:A.氢气通过灼热的CuO粉末,固体由CuO变为Cu,质量减轻,故A正确;
B.2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2→Na2CO3,固体增重,故B错误;
C.铝与Fe2O3发生铝热反应,2Al+Fe2O3$\frac{\underline{\;加热\;}}{\;}$Al2O3+2Fe,固体质量不变,故C错误;
D.将铁钉投入Cu(NO3)2溶液,Fe+Cu(NO3)2=Fe(NO3)2+Cu,析出的Cu附着在铁钉表面,铁钉质量增重,故D错误;
故选A.
点评 本题考查了化学方程式的有关计算,难度中等,熟练书写化学方程式并通过化学式比较固体质量的变化是关键.

练习册系列答案
相关题目
18.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,根据此反应判断下列有关该电池的说法错误的是( )
| A. | 该电池的正极板上覆盖有PbO2,负极板上覆盖有Pb | |
| B. | 该电池放电时的正极反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l) | |
| C. | 该电池充电时,两个电极上都有PbSO4生成 | |
| D. | 用该电池电解饱和食盐水制氯气,若制得0.050molCl2,这时电池内消耗H2SO40.10mol |
19.下列各组物质中,所含分子数相同的是( )
| A. | 5.6LN2(标准状况)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (标准状况)和0.1molN2 |
16.解释下列事实的反应方程式正确的是( )
| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
3.下列有关“化学与生活”的叙述不正确的是( )
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
13.NaHCO3是一种酸式盐,其水溶液显碱性,是重要的化工产品和化学试剂.
(1)NaHCO3俗称小苏打,其水溶液显碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl.
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出.
①倒置灭火器时发生反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液.你认为此建议不合理(填“合理”或“不合理”),理由是等浓度、等体积的NaHCO3与Na2CO3相比,和Al2(SO4)3溶液反应时,NaHCO3生成的CO2既快又多.
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
①该混合物中NaHCO3的物质的量分数为45.65%;
②所用盐酸的物质的量浓度是3mol•L-1.
(1)NaHCO3俗称小苏打,其水溶液显碱性的原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
(2)工业上制备NaHCO3的方法是:先向饱和食盐水通入足量的NH3,再通入过量的CO2得到NaHCO3沉淀,写出该反应的化学方程式NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl.
(3)泡沫灭火器内含一定浓度的NaHCO3(置于铁桶内)和Al2(SO4)3溶液(置于玻璃瓶内)以及起泡剂,使用时把灭火器倒置即有泡沫状物质喷出.
①倒置灭火器时发生反应的离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑;
②有人认为Na2CO3价格便宜,建议用等物质的量浓度、等体积的Na2CO3溶液代替NaHCO3溶液.你认为此建议不合理(填“合理”或“不合理”),理由是等浓度、等体积的NaHCO3与Na2CO3相比,和Al2(SO4)3溶液反应时,NaHCO3生成的CO2既快又多.
(4)由NaHCO3和KHCO3组成的混合物,与50mL等浓度的盐酸分别反应,测得如下数据:
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
②所用盐酸的物质的量浓度是3mol•L-1.
20.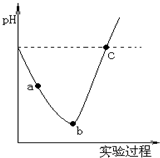 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
17.实验中需要1mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取的Na2CO3•10H2O的质量分别为( )
| A. | 1000mL,106g | B. | 1000mL,286g | C. | 950mL,100.7g | D. | 950mL,271.7g |
18.下列说法正确的是( )
| A. | 铁制品锈蚀时主要发生析氢腐蚀 | |
| B. | 施用适量石膏可以降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| C. | 电镀厂未经处理的废水可以直接用来灌溉农田 | |
| D. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 |