题目内容
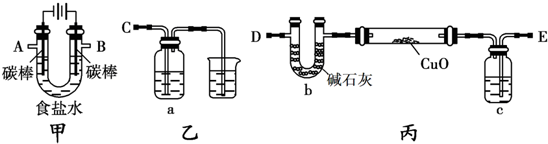
16.解释下列事实的反应方程式正确的是( )| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
分析 A.水解为可逆反应,以第一步水解为主;
B.反应生成硫酸铜、二氧化硫和水;
C.Fe失去电子生成亚铁离子;
D.反应生成氯化铵固体.
解答 解:A.纯碱溶液能清洗油污,发生水解的离子反应为CO32-+H2O?HCO3-+OH-,故A错误;
B.铜与浓硫酸共热产生气体的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故B错误;
C.铁钉在潮湿的空气中很快被腐蚀,负极反应为Fe-2e-═Fe2+,故C错误;
D.氨气遇到氯化氢时产生白烟,发生的反应为NH3+HCl═NH4Cl,故D正确;
故选D.
点评 本题考查离子反应及化学反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应、氧化还原反应、电极反应的考查,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
6.质量分数为15%的硫酸溶液18毫升,密度为1.102g•mL-1,则它的物质的量浓度最接近下列数值中的( )
| A. | 1.685mol•L-1 | B. | 3.370 mol•L-1 | C. | 22.49 mol•L-1 | D. | 11.24 mol•L-1 |
7.实验室制取下列物质的实验中未利用冷凝原理的是( )
| A. | 乙酸乙酯 | B. | 乙酸丁酯 | C. | 溴乙烷 | D. | 乙烯 |
8.下列物质反应以后,固体物质的质量减轻的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |
5.已知如表数据,对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| C. | 向该混合溶液中加入适量H2O2,并调节pH到3~4后过滤可获得纯净的CuSO4溶液 | |
| D. | 在pH=5的溶液中Fe3+不能大量存在 |
6.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 26g乙炔所含共用电子对数目为3NA | |
| B. | 标准状况下,11.2L三氯甲烷所含的分子数为0.5NA | |
| C. | 一定条件下,2.6g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1mol甲基含10NA个电子 |
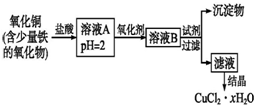 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; .
.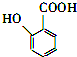 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有6种;其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是 .
.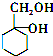 的合成路线流程图(自选无机试剂).合成路线流程图示例:
的合成路线流程图(自选无机试剂).合成路线流程图示例: