题目内容
18.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,根据此反应判断下列有关该电池的说法错误的是( )| A. | 该电池的正极板上覆盖有PbO2,负极板上覆盖有Pb | |
| B. | 该电池放电时的正极反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l) | |
| C. | 该电池充电时,两个电极上都有PbSO4生成 | |
| D. | 用该电池电解饱和食盐水制氯气,若制得0.050molCl2,这时电池内消耗H2SO40.10mol |
分析 根据放电时的电池反应PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,Pb在反应中失去电子,为电池的负极,PbO2在放电过程中得到电子被还原,所以它是原电池的正极;原电池放电的过程中消耗硫酸,据此进行解答.
解答 解:A.原电池中负极失去电子发生氧化反应,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,负极Pb失去电子,即Pb为负极,PbO2为正极,故A正确;
B.根据电池反应可知,正极上发生的电子的还原反应,反应为PbO2(s)+4H+(aq)+SO2-4(aq)+2e-═PbSO4(s)+2H2O(l),故B正确;
C.在负极上是Pb失电子的过程,会产生硫酸铅,但是正极上不会产生硫酸铅,故C错误;
D.该电池电解饱和食盐水制氯气,若制得0.050molCl2,转移电子是0.1mol,根据电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O可知,这时电池内消耗H2SO40.10mol,故D正确;
故选C.
点评 本题考查了常见的化学电源及工作原理,题目难度中等,注意掌握常见化学电源的类型及工作原理,能够根据原电池总反应判断两极,并能够正确书写电极反应式.

练习册系列答案
相关题目
8.下列有关银镜反应实验的说法不正确的是( )
| A. | 实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤 | |
| B. | 向2%的硝酸银溶液中滴入2%的稀氨水,直至产生的沉淀恰好溶解,配得银氨溶液 | |
| C. | 采用水浴加热,不能直接加热 | |
| D. | 可用浓盐酸洗去银镜 |
9.下列各组物质全部是弱电解质的是( )
| A. | H2O、NH3•H2O、H3PO4 | B. | Cu(OH)2、CH3COOH、C2H5OH | ||
| C. | H2SO3、Ba(OH)2、BaSO4 | D. | H2SiO3、H2S、CO2 |
6.质量分数为15%的硫酸溶液18毫升,密度为1.102g•mL-1,则它的物质的量浓度最接近下列数值中的( )
| A. | 1.685mol•L-1 | B. | 3.370 mol•L-1 | C. | 22.49 mol•L-1 | D. | 11.24 mol•L-1 |
3.下列离子组在溶液中能大量共存的是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | K+、H+、CO32-、HCO3- | ||
| C. | Ca2+、Ba2+、Cl-、HCO3- | D. | Na+、Ba2+、HCO3-、OH- |
7.实验室制取下列物质的实验中未利用冷凝原理的是( )
| A. | 乙酸乙酯 | B. | 乙酸丁酯 | C. | 溴乙烷 | D. | 乙烯 |
8.下列物质反应以后,固体物质的质量减轻的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 铝与Fe2O3发生铝热反应 | D. | 将铁钉投入Cu(NO3)2溶液 |




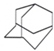 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.判断由氯原子取代金刚烷中的亚甲基(-CH2-)中的氢原子所形成的二氯代物的种类有( )