题目内容
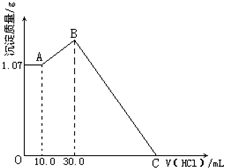 将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:
将FeCl3、AlCl3两种固体混合物溶于足量水后加入一定量的NaOH溶液,产生1.07g红褐色沉淀,再向所得浊液中逐滴滴加1.00mol?L-1HCl溶液,加入HCl溶液的体积与生产沉淀的关系如图所示,试回答:(1)A点的沉淀物的化学式为
(2)写出A点至B点发生反应的离子方程式
(3)原混合物中AlCl3的质量是
(4)C点HCl溶液的体积为
考点:离子方程式的有关计算,镁、铝的重要化合物,铁的氧化物和氢氧化物
专题:计算题
分析:图象分析加入盐酸反应过程是,开始沉沉的无变化,说明原氢氧化钠过量,A点为Fe(OH)3沉淀的质量,0-10ml盐酸和氢氧化钠反应,10-30ml是偏铝酸钠和盐酸反应生成氢氧化铝沉淀的过程,达到最大量沉淀后,继续加入盐酸,Al(OH)3、Fe(OH)3沉淀开始溶解到完全溶解,先分段分析图象,分析每一段图象发生的化学反应有哪些、拐点溶液中溶质的成分是什么,然后结合方程式、原子守恒求出各个物理量.
解答:
解:向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10ml,随盐酸的体积增加,生成沉淀的质量不变,
说明A点沉淀是Fe(OH)3,m[Fe(OH)3]=1.07g,NaOH、AlCl3、FeCl3组成的混合物,溶于足量水发生反应是:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-C点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Fe(OH)3+3HCl=FeCl3+3H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥C点,Fe(OH)3和Al(OH)3完全反应,溶液为FeCl3、AlCl3和NaCl混合液.
(1)A处的沉淀为Fe(OH)3,因为加入10.0mlHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀为Fe(OH)3;
故答案为:Fe(OH)3;因为加入10.0mlHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀为Fe(OH)3;
(2)10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓,
故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(3)选30ml处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、FeCl3和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH.
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl
0.02mol 0.02L×1mol/L=0.02mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g
由Fe原子守恒得原混合物中n(FeCl3)=n[Fe(OH)3]=
=0.01mol,FeCl3的质量=0.01mol×162.5g/mol=1.625g;
故答案为:2.67;1.625;
(4)由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=3n(FeCl3)+3n(AlCl3)+n(HCl)=0.01mol×3+0.02mol×3+0.03L×1mol/L=0.12mol,C点溶液为FeCl3、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.12mol;C点所表示盐酸的体积为:V=
=0.12L=120mL,
故答案为:120.
①0-10ml,随盐酸的体积增加,生成沉淀的质量不变,
说明A点沉淀是Fe(OH)3,m[Fe(OH)3]=1.07g,NaOH、AlCl3、FeCl3组成的混合物,溶于足量水发生反应是:FeCl3+3NaOH=Fe(OH)3↓+3NaCl;
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-C点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Fe(OH)3+3HCl=FeCl3+3H2O;Al(OH)3+3HCl=AlCl3+3H2O;
⑥C点,Fe(OH)3和Al(OH)3完全反应,溶液为FeCl3、AlCl3和NaCl混合液.
(1)A处的沉淀为Fe(OH)3,因为加入10.0mlHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀为Fe(OH)3;
故答案为:Fe(OH)3;因为加入10.0mlHCl恰好中和过量的NaOH,再加HCl沉淀增多,说明[Al(OH)4]-转化为Al(OH)3,故A点沉淀为Fe(OH)3;
(2)10ml-30ml,即A点→B点,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓,
故答案为:H2O+AlO2-+H+=Al(OH)3↓;
(3)选30ml处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、FeCl3和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH.
NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl
0.02mol 0.02L×1mol/L=0.02mol
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g
由Fe原子守恒得原混合物中n(FeCl3)=n[Fe(OH)3]=
| 1.07g |
| 107g/mol |
故答案为:2.67;1.625;
(4)由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=3n(FeCl3)+3n(AlCl3)+n(HCl)=0.01mol×3+0.02mol×3+0.03L×1mol/L=0.12mol,C点溶液为FeCl3、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)=n(NaOH)=0.12mol;C点所表示盐酸的体积为:V=
| 0.12mol |
| 1mol/L |
故答案为:120.
点评:本题考查了铝、镁及其化合物性质的分析判断,图象分析方法,对于图象分析题的解题规律:要明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析,题目难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
NA表示阿伏加德常数,下列说法正确的是( )
| A、2.24L HCl气体中含有0.1NA个HCl分子 |
| B、室温下,1molCH4含有的电子数为10NA |
| C、将0.1mol FeCl3溶于1L水中,所得溶液中含有0.1NA个Fe3+ |
| D、25℃时,1LpH=13的Ba(OH)2溶液中含有0.2NA个OH- |
下列叙述正确的是( )
| A、纯碱、烧碱均属碱 |
| B、CO、SO2均属酸性氧化物 |
| C、凡能电离出H+的化合物均属酸 |
| D、盐类物质一定含有金属离子或铵根离子 |
欲鉴别碳酸钠和亚硫酸钠,应选用的试剂是( )
| A、氯化钡溶液 |
| B、盐酸和品红溶液 |
| C、盐酸和澄清石灰水 |
| D、氯化钡溶液和盐酸 |
下列叙述中正确的是( )
| A、同一周期中,碱金属元素的第一电离能最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、若X原子2p轨道上有一个空轨道,Y原子3p轨道上只有一个空轨道,则它们一定同主族 |
| D、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子则它们一定同主族 |
今有含碳酸氢钠的碳酸钠样品10.0g,放在空气中加热至质量恒重为9.38g;则样品中碳酸钠的质量分数为( )
| A、91.6% |
| B、83.2% |
| C、75.0% |
| D、67.6% |
 某混合溶液中,只可能大量含有下表所列离子中的某几种:
某混合溶液中,只可能大量含有下表所列离子中的某几种: