题目内容
13.二氢荆芥内酯是有效的驱虫剂.其合成路线如下: $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯(1)A中有3个手性碳原子,B的结构简式为
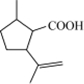 .
.(2)写出D在NaOH溶液中加热发生反应的化学方程式:
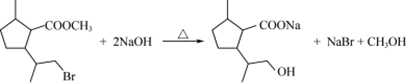 .
.(3)E中含氧官能团的名称是羧基、羟基.
(4)某物质X:①分子组成比A少2个氢原子;②分子中有4种不同环境的氢原子;③能与FeCl3溶液发生显色反应.写出一种符合上述条件的物质X的结构简式:
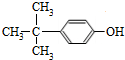 .
.(5)写出由
 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路线流程图示例如下:CH2═CH2 $\stackrel{Br}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
分析 B与甲醇反应得到C,对比A、C结构,可知A发生氧化反应得到B,B发生酯化反应得到C,则B的结构简式为 ,C与HBr发生加成反应生成D,D发生酯的水解、卤代烃水解反应后酸化得到E,E发生酯化反应得到F,结构F的结构简式可知,E为
,C与HBr发生加成反应生成D,D发生酯的水解、卤代烃水解反应后酸化得到E,E发生酯化反应得到F,结构F的结构简式可知,E为 ,D为
,D为 .
.
(1)连接4个不同原子或原子团的碳原子为手性碳原子;
(2)D在氢氧化钠水溶液加热条件下发生酯的水解、卤代烃水解反应,-COOH转化为-COONa,-Br被-OH取代;
(3)根据化合物E的结构,可知其含有官能团为羧基、羟基;
(4)某物质X能与FeCl3溶液发生显色反应,属于酚类,A的不饱和度为4,X分子组成比A少2个氢原子,则X的不饱和度为4,则X含有一个苯环,侧链没有不饱和键,X分子中有4种不同环境的氢原子,可以是-OH与-C(CH3)3处于对位;
(5)用K2Cr2O7将BrCH2CH2CH2CH2OH氧化为BrCH2CH2CH2COOH,然后在氢氧化钠水溶液、加热条件下发生水解反应,再酸化得到HOCH2CH2CH2COOH,最后在浓硫酸、加热条件下发生酯化反应得到 .
.
解答 解:B与甲醇反应得到C,对比A、C结构,可知A发生氧化反应得到B,B发生酯化反应得到C,则B的结构简式为 ,C与HBr发生加成反应生成D,D发生酯的水解、卤代烃水解反应后酸化得到E,E发生酯化反应得到F,结构F的结构简式可知,E为
,C与HBr发生加成反应生成D,D发生酯的水解、卤代烃水解反应后酸化得到E,E发生酯化反应得到F,结构F的结构简式可知,E为 ,D为
,D为 .
.
(1)连接4个不同原子或原子团的碳原子为手性碳原子,环上连接侧链的碳原子均为手性碳原子,有3个手性碳原子,由上述分析可知,B的结构简式为: ,
,
故答案为:3; ;
;
(2)D在氢氧化钠水溶液加热条件下发生酯的水解、卤代烃水解反应,-COOH转化为-COONa,-Br被-OH取代,反应方程式为: ,
,
故答案为: ;
;
(3)E为 ,可知其含有官能团为羧基、羟基,
,可知其含有官能团为羧基、羟基,
故答案为:羧基、羟基;
(4)某物质X能与FeCl3溶液发生显色反应,属于酚类,A的不饱和度为4,X分子组成比A少2个氢原子,则X的不饱和度为4,则X含有一个苯环,侧链没有不饱和键,X分子中有4种不同环境的氢原子,可以是-OH与-C(CH3)3处于对位,结构简式为: ,
,
故答案为: ;
;
(5)用K2Cr2O7将BrCH2CH2CH2CH2OH氧化为BrCH2CH2CH2COOH,然后在氢氧化钠水溶液、加热条件下发生水解反应,再酸化得到HOCH2CH2CH2COOH,最后在浓硫酸、加热条件下发生酯化反应得到 ,合成路线流程图为:BrCH2CH2CH2CH2OH$\stackrel{K_{2}Cr_{2}O_{7}}{→}$BrCH2CH2CH2COOH$→_{△}^{NaOH水溶液}$HOCH2CH2CH2COONa$\stackrel{H+}{→}$HOCH2CH2CH2COOH$→_{△}^{浓硫酸}$
,合成路线流程图为:BrCH2CH2CH2CH2OH$\stackrel{K_{2}Cr_{2}O_{7}}{→}$BrCH2CH2CH2COOH$→_{△}^{NaOH水溶液}$HOCH2CH2CH2COONa$\stackrel{H+}{→}$HOCH2CH2CH2COOH$→_{△}^{浓硫酸}$ ,
,
故答案为:BrCH2CH2CH2CH2OH$\stackrel{K_{2}Cr_{2}O_{7}}{→}$BrCH2CH2CH2COOH$→_{△}^{NaOH水溶液}$HOCH2CH2CH2COONa$\stackrel{H+}{→}$HOCH2CH2CH2COOH$→_{△}^{浓硫酸}$ .
.
点评 本题考查有机物的推断与合成,注意根据合成流程中的物质结构分析解答,需要学生熟练掌握官能团的性质与转化,侧重对学生知识迁移应用能力的考查,题目难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水硫酸铜粉末溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将0.2mol/L稀硫酸与等质量的蒸馏水混合后,浓度大于0.1mol/L | |
| D. | 将1体积1mol/L的稀硫酸用水稀释到5体积,溶液的浓度为0.2mol/L |
| A. | 二氧化硅 | B. | 硅 | C. | 硅酸 | D. | 硅酸钠 |
| A. | H2O | B. | CCl4 | C. | NaOH(aq) | D. | H2SO4(浓) |
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析.具体步骤如图所示:
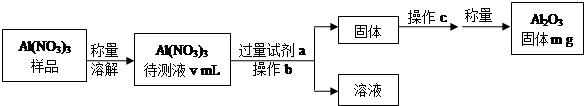
①加入试剂a后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为过滤,操作c为洗涤、灼烧(或加热)、冷却.
③Al(NO3)3待测液中,c (Al3+)=$\frac{1000m}{51v}$mol•L-1(用m、v表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
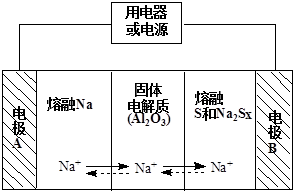
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为负极.
③放电时,内电路中Na+的移动方向为从A到B(填“从A到B”或“从B到A”).
④充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS.
| A. | 150 mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L NH4Cl溶液 | ||
| C. | 75 mL 2 mol/L AlCl3溶液 | D. | 150 mL 1.5 mol/L MgCl2溶液 |
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
⑥用FeCl3溶液腐蚀铜制印刷电路板:2Fe3++Cu=2Fe2++Cu2+.
| A. | 仅①③④⑤ | B. | 仅②③④ | C. | 仅①③④ | D. | 仅①②④⑤ |
| A. | 在卤代烃中,卤素原子与碳原子间形成共价键 | |
| B. | 在溴乙烷(CH3CH2Br)分子中,溴元素的存在形式为溴离子 | |
| C. | 聚四氟乙烯(塑料王)为高分子化合物,不属于卤代烃 | |
| D. | 卤代烃的沸点比相应烷烃的沸点低 |
