题目内容
9.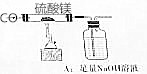 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:①向装置中先通一段时间CO,然后开始加热.
②加热一段时间,停止加热,继续通CO至石英管冷却至室温;称量石英管中剩余固体质量为3.6g(经分析可知固体中含有MgO和MgSO4).
③向洗气瓶A中的溶液中加入足量BaCl2溶液至不再产生沉淀;经过滤、洗涤、干燥,称量沉淀质量为29.5g.
④向上述沉淀中加入足量稀盐酸至沉淀不再溶解,经过滤、洗涤、干燥,称量剩余沉淀质量为4.66g.
⑤依据上述实验数据,可计算出产物中SO3和CO2的体积比为1:3
(1)上述装置有明显缺陷,请指出无尾气收集或处理装置.
(2)步骤③中生成的沉淀为BaSO4、BaCO3、BaSO3,.
(3)步骤④中洗涤沉淀的方法是取沉淀放在过滤器中,加入蒸馏水浸没沉淀待水自然流下,重复2-3次洗涤干净.
(4)根据上述实验数据,写出CO还原MgSO4的化学方程式4MgSO4+3CO $\frac{\underline{\;高温\;}}{\;}$SO3+3CO2+3SO2+4MgO.
(5)根据上述数据计算石英管中制得的MgO纯度为88.9%(保留至0.1%)
分析 ①向装置中先通一段时间CO,然后开始加热.
②加热一段时间,停止加热,继续通CO至石英管冷却至室温;称量石英管中剩余固体质量为3.6g(经分析可知固体中含有MgO和MgSO4).
③向洗气瓶A中的溶液中加入足量BaCl2溶液至不再产生沉淀;经过滤、洗涤、干燥,称量沉淀质量为29.5g.
④向上述沉淀中加入足量稀盐酸至沉淀不再溶解,经过滤、洗涤、干燥,称量剩余沉淀质量为4.66g.判断沉淀为BaSO4,物质的量n(BaSO4)=$\frac{4.66g}{233g/mol}$
=0.02mol,
⑤依据上述实验数据,可计算出产物中SO3和CO2的体积比为1:3,一氧化碳还原硫酸镁生成产物有MgO、SO3、CO2,依据氧化还原反应可知,则一定有元素化合价降低的硫元素,生成产物中含有SO2,
所以③生成沉淀为BaSO4、BaCO3、BaSO3,其中n(SO3)=n(BaSO4)=0.02mol,n(CO2)=n(BaCO3)=0.06mol,
m(BaCO3)=0.06mol×197g/mol=11.82g,
m(BaSO3)=29.5g-4.66g-11.82g=13.02g
n(BaSO3)=$\frac{13.02g}{217g/mol}$=0.06mol,据此计算回答问题,
(1)装置中无尾气收集或处理装置;
(2)上述分析可知步骤③中生成的沉淀硫酸钡、碳酸钡、亚硫酸钡;
(3)洗涤沉淀方法是在过滤器中加入水浸没沉淀待水自然流下,重复2-3次;
(4)依据上述计算和原子守恒、气体物质的量配平书写化学方程式;
(5)依据化学方程式计算生成的氧化镁物质的量得到氧化镁质量,纯度=$\frac{氧化镁质量}{3.6g}$×100%.
解答 解:实验步骤④向上述沉淀中加入足量稀盐酸至沉淀不再溶解,经过滤、洗涤、干燥,称量剩余沉淀质量为4.66g.判断沉淀为BaSO4,物质的量n(BaSO4)=$\frac{4.66g}{233g/mol}$
=0.02mol,
依据上述实验数据,可计算出产物中SO3和CO2的体积比为1:3,则一氧化碳还原硫酸镁生成产物有MgO、SO3、CO2,依据氧化还原反应可知,碳元素化合价升高,则一定有元素化合价降低的硫元素,生成产物中含有SO2,一氧化碳还原硫酸镁生成二氧化硫、三氧化硫、二氧化碳、氧化镁,
所以步骤③中生成沉淀为BaSO4、BaCO3、BaSO3,
其中n(SO3)=n(BaSO4)=0.02mol,
n(CO2)=n(BaCO3)=0.06mol,
m(BaCO3)=0.06mol×197g/mol=11.82g,
m(BaSO3)=29.5g-4.66g-11.82g=13.02g
n(SO2)=n(BaSO3)=$\frac{13.02g}{217g/mol}$=0.06mol,据此计算回答问题,
(1)一氧化碳是有毒气体不能直接排放,上述装置有明显缺陷,无尾气收集或处理装置,故答案为:无尾气收集或处理装置;
(2)上述分析可知步骤③中生成的沉淀硫酸钡、碳酸钡、亚硫酸钡,化学式为:BaSO4、BaCO3、BaSO3,故答案为:BaSO4、BaCO3、BaSO3;
(3)洗涤沉淀方法是:取沉淀放在过滤器中,加入蒸馏水浸没沉淀待水自然流下,重复2-3次洗涤干净,
故答案为:取沉淀放在过滤器中,加入蒸馏水浸没沉淀待水自然流下,重复2-3次洗涤干净;
(4)依据上述计算和原子守恒、气体物质的量,n(SO3):n(CO2):n(SO2)=1:3:3,CO还原MgSO4的化学方程式为:4MgSO4+3CO$\frac{\underline{\;高温\;}}{\;}$SO3+3CO2+3SO2+4MgO,
故答案为:4MgSO4+3CO$\frac{\underline{\;高温\;}}{\;}$SO3+3CO2+3SO2+4MgO;
(5)依据化学方程式计算,4MgSO4+3CO$\frac{\underline{\;高温\;}}{\;}$SO3+3CO2+3SO2+4MgO,生成三氧化硫物质的量为0.02mol,
生成的氧化镁物质的量n(MgO)=0.08mol,
得到氧化镁纯度=$\frac{氧化镁质量}{3.6g}$×100%=$\frac{0.08mol×40g/mol}{3.6g}$×100%=88.9%,
故答案为:88.9%.
点评 本题考查了物质组成实验探究、反应产物的计算判断、氧化还原反应单质守恒和元素守恒等知识点,主要是反应产物的分析判断,掌握基础是解题关键,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案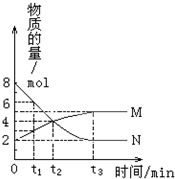 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,保持恒温恒容,再充入N,N的转化率保持不变 | |
| D. | t3时,其他条件不变,改变温度,平衡一定发生移动 |
| A. | 8.7g | B. | 3.15g | C. | 4.35g | D. | 4.0g |
| A. | 二氧化硅 | B. | 硅 | C. | 硅酸 | D. | 硅酸钠 |
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析.具体步骤如图所示:
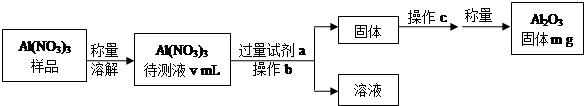
①加入试剂a后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为过滤,操作c为洗涤、灼烧(或加热)、冷却.
③Al(NO3)3待测液中,c (Al3+)=$\frac{1000m}{51v}$mol•L-1(用m、v表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
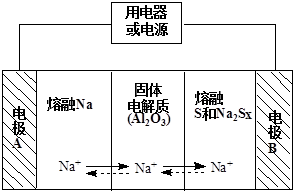
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为负极.
③放电时,内电路中Na+的移动方向为从A到B(填“从A到B”或“从B到A”).
④充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS.
| A. | C3H7Cl | B. | C3H8 | C. | C3H6 | D. | C |


