题目内容
20.下列图象能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol)( )| A. | 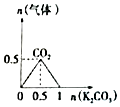 n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. | 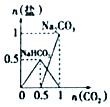 n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. | 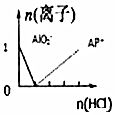 n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. | 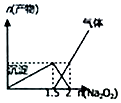 n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
分析 A.K2CO3逐步加入到HCl溶液中,发生K2CO3+2HCl═2KCl+H2O+CO2↑;
B.CO2逐步通入到NaOH溶液中,发生CO2+2NaOH═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3;
C.HCl逐步通入到NaAlO2溶液中,发生NaAlO2+4HCl═AlCl3+NaCl+2H2O;
D.Na2O2逐步加入到AlCl3溶液中,发生2Na2O2+2H2O═4NaOH+O2↑、AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O.
解答 解:A.因开始反应时盐酸过量,则发生K2CO3+2HCl═2KCl+H2O+CO2↑,n(HCl)=1mol时生成0.5mol二氧化碳后再加盐酸不反应,气体不会减少,图象与反应不符,故A错误;
B.因开始碱过量,则发生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol时生成0.5molNa2CO3,再加人二氧化碳发生Na2CO3+H2O+CO2═2NaHCO3,则最终碳酸钠减少为0,碳酸氢钠生成1mol,图象与反应不符,故B错误;
C.因开始NaAlO2过量,则发生NaAlO2+4HCl═AlCl3+NaCl+2H2O,n(NaAlO2)=1mol时生成1mol铝离子,图象与反应符合,故C正确;
D.据2Na2O2+2H2O═4NaOH+O2↑,故开始添加Na2O2就有气体生成,图象与反应不符,故D错误;
故选C.
点评 本题考查化学反应与图象的关系,为高频考点,把握图象中的线、点的意义及对应的化学反应是解答本题的关键,并注意反应物的量对反应的影响来分析反应的产物,题目难度中等.

练习册系列答案
相关题目
11.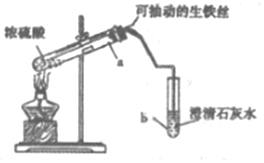 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
①装置的连接顺序(按产物气流从左至右的方向→E→A→C→D→B(填装置的编号)
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.(1)该实验的操作依次是CAB (填序号).
A.加热a试管直到b中澄淸石灰水变浑浊,熄灭酒精灯
B.将生铁丝上提离开液面
C.连接好装置,检验气密性,加人试剂
(2)b中的澄清石灰水变浑浊,甲同学认为产生的肯定是SO2气体,你是否同意不同意(填“同意”或“不同意)理由是.
(3)乙同学认为该反应过程中产生SO2、CO2、H2三种气体,请用如图所列各装置设计一个实验,来验证所产生的气体.(图中加热装置、夹持仪器省略,除装置⑤外,其他装置试剂均为足量)
| A | B | C | D | E |
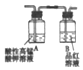 |  |  |  | 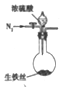 |
②证明生成的气体中存在SO2的现象是装置①中溶液紫红色变浅说明生成SO2,相应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
(4)用2L0.3mol•L-1的NaOH溶液吸收标准状况下的11.2L的SO2气体生成的Na2SO3和NaHSO3的物质的量之比为1:4
(5)已知常温下H2SO3的电离平衡常数为:Ka1=10×10-1.9 Ka2=10-7.2计算0.1mol•L-1NaSO3溶液的pH
值10.1(忽略SO32-的二级水解)
8.下列叙述正确的是( )
| A. | 在空气质量日报中CO2含量属于空气污染指数 | |
| B. | 日常生活中和医院常用无水乙醇杀菌消毒 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 目前加碘食盐中主要添加的是KIO3 |
15.化学与社会可持续发展密切相关.下列做法不合理的是( )
| A. | 将废旧电池集中深埋,防止重金属污染 | |
| B. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| C. | 推广碳捕集和转化成化工原料技术,逐步实现二氧化碳零排放 | |
| D. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 |
5.钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:
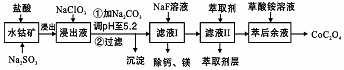
已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(3)浸出过程中加入NaClO3的目的是将Fe2+氧化为Fe3+,利于从混合液中除去.
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
12.战国所著《周礼》中记载沿海古人“煤饼烧砺房成灰”(“砺房”即牡蜗壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
9.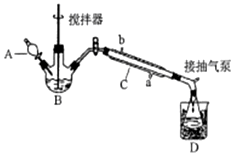 过氧乙酸(
过氧乙酸( 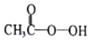 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
(1)C仪器中冷水流入口是a(填a或b),生成过氧乙酸的化学方程式是CH3COOH+H2O2$\frac{\underline{\;浓硫酸\;}}{\;}$CH3COOOH+H2O.
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
 过氧乙酸(
过氧乙酸( 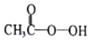 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
10.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |