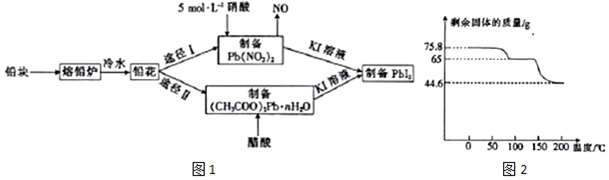
题目内容
15.下列有关化学用语表达不正确的是( )| A. | Na的原子结构示意图: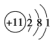 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: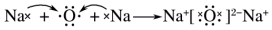 |
分析 A.钠原子的核电荷数=核外电子总数=11,最外层含有1个电子;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氮气分子中含有1个氮氮三键,氮氮三键的表示方法错误;
D.氧化钠为离子化合物,阴阳离子需要标出所带电荷,阴离子还要标出最外层电子.
解答 解:A.Na的核外电子总数为11,其原子结构示意图为: ,故A正确;
,故A正确;
B.含有6个质子和7个中子的碳元素的质量数为13,该核素可以表示为:${\;}_{6}^{13}$C,故B正确;
C.氮气分子中含有氮氮三键,其正确的电子式为 ,故C错误;
,故C错误;
D.氧化钠为离子化合物,钠离子直接用离子符号表示,氧离子需要标出最外层电子及所带电荷,用电子式表示氧化钠的形成过程为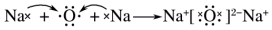 ,故D正确;
,故D正确;
故选C.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、原子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.钴周期表第四周期第ⅥⅡ族元素,其化合价用途广泛,如:LiCoO2做锂电池的正极材料,草酸钴可用于指示剂和催化剂制备.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(3)浸出过程中加入NaClO3的目的是将Fe2+氧化为Fe3+,利于从混合液中除去.
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
Ⅰ(1)LiCoO2中钴元素的化合价为+3.
(2)工业上将废锂电池的正极材料与过氧化氢溶液、稀硫酸混合加热,可得到CoSO4回收,反应的化学方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2+4H2O可用盐酸代替H2SO4和H2O2的混合液,但缺点是生成的氯气造成污染,且盐酸易挥发,浪费很大.
Ⅱ利用一种含钴矿石[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如下:

已知:已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(4)请用平衡移动原理说明加Na2CO3调PH至5.2生成沉淀的原因因Fe3+和Al3+(用M3+代替)在水溶液中存在平衡M3++H2O?M(OH)3+3H+,加入碳酸钠后CO32-与H+结合生成难电离的HCO3-,使水解平衡右移而产生沉淀.
(5)滤液Ⅱ中加入萃取剂的作用是除去Mn2+.
(6)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
3.下列关于物质性质变化的比较中,正确的是( )
| A. | 酸性强弱HIO4<HBrO4<HClO4 | B. | 原子半径大小S>Na>O | ||
| C. | 碱性强弱KOH<NaOH<LiOH | D. | 金属性强弱Na<Mg<Al |
10.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
20.下列变化中,未破坏化学键的是( )
| A. | HCl溶于水 | B. | 烧碱受热熔化 | C. | 碘的升华 | D. | CaO溶于水 |
7.在C5H12的各种同分异构体中,所含甲基数目和它的一氯取代物的数目与叙述相符的是( )
| A. | 2个-CH3,能生成3种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成2种一氯代物 | D. | 4个-CH3,能生成2种一氯代物 |
4.设NA代表阿伏加罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,由H2O2制得2.24L O2转移的电子数为0.4NA | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | NO2和H2O反应生成2mol HNO3时转移的电子数为4NA | |
| D. | 常温常压下,11.2L NH3中所含氮原子数为0.5NA |