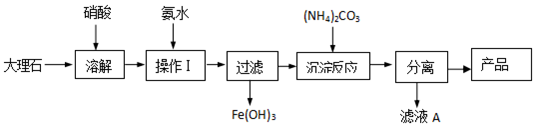
题目内容
5.2SO2(g)+O2(g)?SO3(g)是制备硫酸的重要反应,下列叙述中正确的是( )| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 不论以何种方式使反应体系的压强增大,化学反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应到达平衡的时间 | |
| D. | 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中 |
分析 A.根据催化剂可以同等程度的增大正逆反应的反应速率;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.温度越低反应速率越慢;
D.平衡时是反应物和生成物共存体系.
解答 解:A、催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B、若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B错误;
C.温度越低反应速率越慢,所以达平衡时间越长,故C错误;
D.平衡时是反应物和生成物共存体系,所以是SO2、O2、SO3都存在于反应体系中,故D正确;
故选D.
点评 本题主要考查化学反应速率与化学平衡的影响的因素,注意理解压强对反应速率、化学平衡的影响,改变压强影响物质的浓度,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.化学与社会可持续发展密切相关.下列做法不合理的是( )
| A. | 将废旧电池集中深埋,防止重金属污染 | |
| B. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| C. | 推广碳捕集和转化成化工原料技术,逐步实现二氧化碳零排放 | |
| D. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 |
13.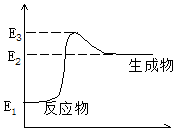 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )| A. | 减小压强时,Q的值增大 | B. | 升高温度时,Q的值减小 | ||
| C. | 该反应是吸热反应 | D. | Q=E3-E1 |
10.下列依据相关实验得出的结论正确的是( )
| A. | 向某溶液中加入稀盐酸,产生的气体通入足量澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| B. | 用洁净铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| C. | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ | |
| D. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
17.有一未完成的离子方程式:( )+RO32-+6H+=3R+3H2O,据此判断,R元素的最高价氧化物对应的水化物的化学式为( )
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
14.下列有关化学与生产、生活的说法正确的是( )
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
11.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
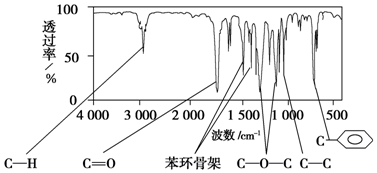
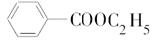 .
.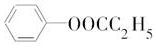 .
.