题目内容
下列文字表述与反应方程式对应且正确的是( )
| A、溴乙烷中滴入硝酸银溶液检验其中的溴元素:Ag++Br-=AgBr↓ | ||||
| B、14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1 | ||||
C、用惰性电极电解饱和KCl溶液:2 H++2 Cl-
| ||||
| D、硫酸亚铁与双氧水、稀H2SO4混合:2 Fe2++H2O2+2 H+=2 Fe3++2 H2O |
考点:离子方程式的书写
专题:
分析:A.溴乙烷为非电解质,不能电离产生溴离子;
B.燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量;
C.水为弱电解质应保留化学式;
D.硫酸亚铁与双氧水、稀H2SO4混合,反应生成硫酸铁和水.
B.燃烧热是指完全燃烧1mol物质生成最稳定产物的过程放出的热量;
C.水为弱电解质应保留化学式;
D.硫酸亚铁与双氧水、稀H2SO4混合,反应生成硫酸铁和水.
解答:
解:A.溴乙烷为非电解质,不能电离产生溴离子,故A错误;
B.C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1,中水为气态,不是最稳定的氧化物,故B错误;
C.用惰性电极电解饱和KCl溶液:2H20+2Cl-
H2↑+Cl2↑+2OH-,故C错误;
D.硫酸亚铁与双氧水、稀H2SO4混合,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,故D正确;
故选:D.
B.C2H4(g)+3 O2(g)═2 H2O(g)+2 CO2(g)△H=-2 b kJ?mol-1,中水为气态,不是最稳定的氧化物,故B错误;
C.用惰性电极电解饱和KCl溶液:2H20+2Cl-
| ||
D.硫酸亚铁与双氧水、稀H2SO4混合,离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O,故D正确;
故选:D.
点评:本题考查了离子方程式的书写,明确反应的实质是解题关键,注意化学式的拆分、燃烧热的定义、离子方程式中原子个数、电荷数守恒,题目难度不大.

练习册系列答案
相关题目
可逆反应A+3B?2C+2D,在4种不同情况下的反应速率分别为单位mol?Lˉ1?sˉ1:①VA=0.20;②VB=0.60;③VD=0.50;④VC=0.45;该反应速率最快的是( )
| A、② | B、③ | C、①和④ | D、②和③ |
下列叙述正确的是( )
| A、1molNaOH的质量为40g?mol-1 |
| B、标准状况下,1molH2O2的体积为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
下列离子方程式书写正确的是( )
| A、将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2O |
| B、向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列化学用语表述一定正确的是( )
A、甲醛的电子式: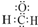 | ||||
B、用铜电极电解盐酸溶液:2H++2Cl
| ||||
C、溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-
| ||||
| D、澄清石灰水中加入过量的小苏打溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
下列对金属氧化物的描述一定不正确的是( )
| A、碱性氧化物 | B、纯净物 |
| C、化合物 | D、混合物 |