题目内容
11.已知:S(s)+O2 (g)=SO2 (g)△H=-297KJ/mol,下列说法不正确的是( )| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
分析 由S(s)+O2(g)═SO2(g)△H=-297kJ/mol,可知该反应为放热反应,S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,以此来解答.
解答 解:A.由S(s)+O2(g)═SO2(g)△H=-297kJ/mol,可知S的燃烧热为297KJ/mol,故A正确;
B.S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则1mol硫蒸气完全燃烧放出的热量大于297 kJ,故B正确;
C.S(s)=S(g)为吸热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)△H<-297.23kJ/mol,则1mol硫蒸气完全燃烧放出的热量大于297 kJ,故C错误;
D.该反应为放热反应,则形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量,故D正确;
故选C.
点评 本题考查燃烧热的热化学反应方程式,明确燃烧的概念及反应热与键能、盖斯定律的关系即可解答,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
1. 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=a kJ•mol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.032mol•L-1•min-1,T1℃时,该反应的平衡常数K=0.25;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ad(填字母编号).
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是bc(填选项编号).
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
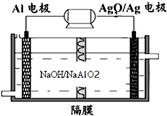
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=2(不考虑溶液体积的变化).
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=a kJ•mol-1
3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ad(填字母编号).
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是bc(填选项编号).
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=2(不考虑溶液体积的变化).
2.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述不正确的是( )
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
19.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
2.下列各种制备物质的方案中,不正确的( )
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
17.硫代硫酸钠可作为脱氯剂,已知50.0mL 0.100mol/L Na2S2O3 溶液恰好把448mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32- 将转化成( )
| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
18.将Na2O2投入足量AlCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀及气泡 | B. | 仅生成白色沉淀 | ||
| C. | 仅有气泡产生 | D. | 无变化 |