题目内容
17.硫代硫酸钠可作为脱氯剂,已知50.0mL 0.100mol/L Na2S2O3 溶液恰好把448mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32- 将转化成( )| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
分析 根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等列式计算.
解答 解:n(Na2S2O3)=0.1mol/L×0.05L=0.005mol,氯气的物质的量=$\frac{0.448L}{22.4L/mol}$=0.02mol,二者完全反应时转移电子相等,设硫代硫酸根离子被氧化后硫元素的化合价为x,
0.02mol×2×(1-0)=0.005mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,故选:A.
点评 本题考查氧化还原反应的计算,题目难度不大,注意从氧化剂、还原剂得失电子数目相等的角度解答.

练习册系列答案
相关题目
10.已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,[饱和Ag2SO4溶液中c(Ag+)=0.032mol•L-1].若t1时刻在上述体系中加入100mL相应溶液,下列示意图中,不能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
| A. |  蒸馏水 | B. | 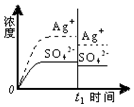 0.010mol•L-1 Ag2SO4溶液 | ||
| C. | 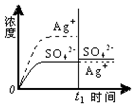 0.020mol•L-1 Na2SO4溶液 | D. | 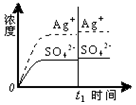 0.040mol•L-1 AgNO3溶液 |
11.已知:S(s)+O2 (g)=SO2 (g)△H=-297KJ/mol,下列说法不正确的是( )
| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
7.下列哪组气体在实验室中可用相同的实验装置制取( )
| A. | H2S H2 CO2 | B. | SO2 Cl2 H2S | ||
| C. | O2 SO2 Cl2 | D. | HCl Cl2 SO2 |
2.下列说法正确的是( )
| A. | 由被氧化的元素组成的反应物是氧化剂 | |
| B. | 在一个氧化还原反应中,氧化反应和还原反应同时发生 | |
| C. | 由化合态转变为游离态的变化一定是还原反应 | |
| D. | 氧化还原反应的实质是元素化合价的升降 |
9.小苏打属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
 .
.
 ,B:
,B: ,C:
,C: .
. pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )