题目内容
18.将Na2O2投入足量AlCl3溶液中,可观察到的现象是( )| A. | 生成白色沉淀及气泡 | B. | 仅生成白色沉淀 | ||
| C. | 仅有气泡产生 | D. | 无变化 |
分析 Na2O2投入足量AlCl3溶液中,Na2O2和水反应生成的氢氧化钠和氧气,氢氧化钠再与足量AlCl3溶液反应生成氢氧化铝的白色沉淀.
解答 解:将Na2O2投入足量AlCl3溶液中,发生的反应为2Na2O2+2H2O=4NaOH+O2↑、3NaOH+AlCl3=Al(OH)3↓+3NaCl,所以看到的现象是:有大量气泡生成,出现白色沉淀.
故选A.
点评 本题考查的是钠化合物的性质、氢氧化钠的性质,正确分析反应过程是解本题的关键,经常考查的还有Na2O2、Na投入CuSO4溶液中观察到的现象.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.已知:S(s)+O2 (g)=SO2 (g)△H=-297KJ/mol,下列说法不正确的是( )
| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
9.小苏打属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
13.根据表中提供的数据,判断可以形成合金的是( )
| 金属或非金属 | 钠 | 铝 | 铁 | 硅 | 硫 |
| 熔点/℃ | 97.8 | 660.4 | 1535 | 1410 | 112.8 |
| 沸点/℃ | 883 | 2467 | 2750 | 2353 | 444.6 |
| A. | 铝与硅 | B. | 铝与硫 | C. | 钠与硫 | D. | 钠与硅 |
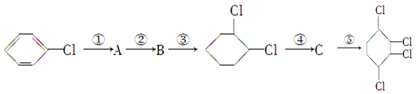
 ,B:
,B: ,C:
,C: .
. .
. 述中,正确的是( )
述中,正确的是( ) pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( ) 氢键有关的是
氢键有关的是