题目内容
13.研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义,请回答下列问题:(1)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2发生反应,则下列说法正确的是DE.
A.若反应速率v(SO2)﹦v(SO3),则可以说明该可逆反应已达到平衡状态
B.保持温度和容器体积不变,充入2mol N2,化学反应速率加快
C.平衡后仅增大反应物浓度,则平衡一定右移,各反应物的转化率一定都增大
D.平衡后移动活塞压缩气体,平衡时SO2、O2的百分含量减小,SO3的百分含量增大
E.保持温度和容器体积不变,平衡后再充入2mol SO3,再次平衡时各组分浓度均比原平衡时的浓度大
F.平衡后升高温度,平衡常数K增大
(2)若某温度下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ/mol.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=$\frac{10}{3}$(用分数表示).在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,该反应向逆方向进行
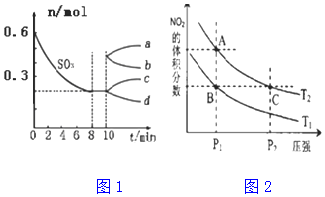
(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,则SO3的变化曲线为c(填图象中的字母序号).
(4)反应N2O4(g)?2NO2(g);△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是C
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若P2>P1,则化学平衡常数KA>KC
(5)用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ/mol
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160KJ/mol
请写出1molCH4还原NO2生成N2、CO2、H2O气态物质的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
分析 (1)A.若反应速率v(SO2)﹦v(SO3),反应方向未知导致无法确定是否达到平衡状态;
B.保持温度和容器体积不变,充入2mol N2,反应物和生成物浓度不变,平衡不移动;
C.平衡后仅增大反应物浓度,则平衡一定右移,加入的该物质转化率降低;
D.平衡后移动活塞压缩气体,平衡正向移动;
E.保持温度和容器体积不变,平衡后再充入2mol SO3,相当于增大压强,平衡正向移动;
F.该反应的正反应是放热反应,升高温度平衡逆向移动;
(2)1molSO2完全反应放出98kJ热量,则放出196kJ热量时消耗二氧化硫2mol,消耗氧气1mol,开始时c(SO2)=$\frac{4.0mol}{100L}$=0.04mol/L,c(O2)=$\frac{10mol}{100L}$=0.1mol/L,
该反应中SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始(mol/L)0.04 0.1 0
反应(mol/L)0.02 0.01 0.02
平衡(mol/L)0.02 0.09 0.02
化学平衡常数K=$\frac{c(S{O}_{3})}{c(S{O}_{2}).\sqrt{c({O}_{2})}}$;
在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,
剩余的c(SO2)=0.2mol/L×(1-60%)=0.08mol/L,c(O2)=0.1mol/L-0.2mol/L×60%×$\frac{1}{2}$=0.04mol/L,生成的c(SO3)=0.2mol/L×60%=0.12mol/L,
根据浓度商与化学平衡常数相对大小确定反应方向;
(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,容器体积减小导致10min时c(SO3)增大但n(SO3)不变,增大压强平衡正向移动,n(SO3)逐渐增大;
(4)A.A点压强小于C点,压强越大,反应速率越大;
B.增大压强平衡逆向移动,但C点二氧化氮浓度大于A点;
C.由状态B到状态A,压强不变,应该升高温度;
D.化学平衡常数只与温度有关;
(5)将方程式$\frac{①+②}{2}$得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H进行相应的改变.
解答 解:(1)A.若反应速率v(SO2)﹦v(SO3),反应方向未知导致无法确定是否达到平衡状态,故A错误;
B.保持温度和容器体积不变,充入2mol N2,氮气不参加反应,则反应物和生成物浓度不变,平衡不移动,则反应速率不变,故B错误;
C.平衡后仅增大反应物浓度,则平衡一定右移,加入的该物质转化率降低,其它的气体反应物转化率增大,故C错误;
D.平衡后移动活塞压缩气体,平衡正向移动,则反应物含量降低,生成物含量增大,故D正确;
E.保持温度和容器体积不变,平衡后再充入2mol SO3,相当于增大压强,平衡正向移动,再次平衡时各组分浓度均比原平衡时的浓度大,故E正确;
F.该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,故F错误;
故选DE;
(2)1molSO2完全反应放出98kJ热量,则放出196kJ热量时消耗二氧化硫2mol,消耗氧气1mol,开始时c(SO2)=$\frac{4.0mol}{100L}$=0.04mol/L,c(O2)=$\frac{10mol}{100L}$=0.1mol/L,
该反应中SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
开始(mol/L)0.04 0.1 0
反应(mol/L)0.02 0.01 0.02
平衡(mol/L)0.02 0.09 0.02
化学平衡常数K=$\frac{c(S{O}_{3})}{c(S{O}_{2}).\sqrt{c({O}_{2})}}$=$\frac{0.02}{0.02×\sqrt{0.09}}$=$\frac{10}{3}$;
在该温度下,分别将0.2mol/L 的SO2 和0.1mol/L O2放入固定体积的密闭容器中,当SO2转化率为60%时,
剩余的c(SO2)=0.2mol/L×(1-60%)=0.08mol/L,c(O2)=0.1mol/L-0.2mol/L×60%×$\frac{1}{2}$=0.04mol/L,生成的c(SO3)=0.2mol/L×60%=0.12mol/L,
浓度商=$\frac{0.12}{0.08×\sqrt{0.04}}$=7.5>$\frac{10}{3}$,平衡逆向移动,
故答案为:$\frac{10}{3}$;逆;
(3)在一个2L的密闭容器中充入一定量的SO3发生反应:其中SO3的变化如下图所示:从10 min起,压缩容器为1L,容器体积减小导致10min时c(SO3)增大但n(SO3)不变,增大压强平衡正向移动,n(SO3)逐渐增大,所以选c,故答案为:c;
(4)A.A点压强小于C点,压强越大,反应速率越大,所以反应速率A<C,故A错误;
B.增大压强平衡逆向移动,但C点二氧化氮浓度大于A点,所以颜色A点浅、C点深,故B错误;
C.由状态B到状态A,压强不变,该反应的正反应是吸热反应,升高温度二氧化氮含量增大,则应该升高温度,故C正确;
D.化学平衡常数只与温度有关,A、C点温度相同则平衡常数相同,故D错误;
故选C;
(5)将方程式$\frac{①+②}{2}$得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-$\frac{574+1160}{2}$kJ/mol=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol.
点评 本题考查化学平衡计算、盖斯定律、图象分析等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确平衡移动原理是解本题关键,注意(4)B为易错点,题目难度中等.

| A. | Al2O3-->Al(OH)3 | B. | Cu-->CuCl2 | C. | Fe-->FeCl2 | D. | Na-->NaOH |
| A. | 用石墨作电极电解AlC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++4 O2↑+6H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br -+2NO3-+8H+═3Br2+2NO↑+4H2O |
| A. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>①>② | |
| B. | 将①、④等体积混合,则混合液的PH为7 | |
| C. | 四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ | |
| D. | 将②加入③至恰好完全反应,则消耗体积为③>② |
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 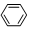 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$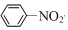 +H2O +H2O |

 .
. .
.