题目内容
7.用高碘酸光度法测定低含量锰的方法误差约为2%.使用称量误差为±0.001g的天平称取MnSO4,若要配制成每毫升含0.2mg硫酸锰标准溶液,至少要配制( )| A. | 50mL | B. | 250mL | C. | 100mL | D. | 1000mL | ||||
| E. | 500mL |
分析 设MnSO4的最低称量质量为m,则2.0%=($\frac{0.001g}{m}$)×100%,据此计算出称量的硫酸锰的质量;再设出配制MnSO4溶液的体积为V,则$\frac{0.2mg}{1}$=$\frac{50mg}{V}$,据此可计算出至少配制该溶液的体积.
解答 解:设MnSO4的最低称量质量为m,则:2.0%=($\frac{0.001g}{m}$)×100%,解得:m=0.05g=50mg,
设配制MnSO4溶液的体积为V,则$\frac{0.2mg}{1}$=$\frac{50mg}{V}$,解得:V=250mL,
所以至少配制的溶液体积为250mL,
故选B.
点评 本题考查了溶液配制的有关计算,题目难度中等,根据误差正确判断硫酸锰的质量为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
3.能正确表示下列反应的离子方程式的是( )
| A. | 氯气通入水中:Cl2+H2O═Cl-+ClO+2H+ | |
| B. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Fe与盐酸反应制H2:2Fe+6H+═2Fe3++3H2↑ |
18.利用下列实验装置能完成相应实验的是( )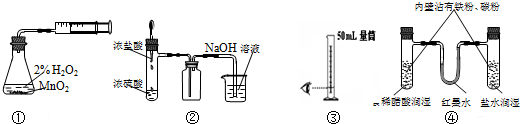

| A. | 装置①制取并收集纯净的氧气 | B. | 装置②制取并吸收HCl | ||
| C. | 装置③量取8.5mL的稀硫酸 | D. | 装置④模拟铁的腐蚀 |
15.X、Y、Z、W均为短周期元素,且Y、Z、W在周期表的位置关系如下.已知X与W能形成最简单的有机物,则下列有关说法正确的是( )
| W | |||
| Y | Z |
| A. | X能分别与Y、W形成化合物,且其所含化学键类型完全相同 | |
| B. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| C. | X的离子半径一定小于Y同族的短周期元素的离子半径 | |
| D. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z |
17.除去Cl2中混有的少量 HC1气体,可将气体通入( )
| A. | 饱和氯化钠溶液 | B. | 饱和碳酸氢钠溶液 | ||
| C. | 澄清石灰水 | D. | 氢氧化钠溶液 |
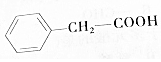 苯乙酸
苯乙酸 .
.