题目内容
15.在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是( )| A. | Na+、K+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
分析 pH=1的溶液,显酸性,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.酸性溶液中不能大量存在OH-,故A不选;
B.Cu2+为蓝色,与无色不符,故B不选;
C.酸性溶液中该组离子之间不反应,可大量共存,故C选;
D.酸性溶液中不能大量存在HCO3-,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应,注意隐含条件的挖掘和利用,题目难度不大.

练习册系列答案
相关题目
6.有Al、CuO、Fe2O3组成的混合物共100g,放入500mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250mL2.0 mol/L的NaOH溶液时,得到的沉淀最多.上述盐酸溶液的液度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
3.能正确表示下列反应的离子方程式的是( )
| A. | 氯气通入水中:Cl2+H2O═Cl-+ClO+2H+ | |
| B. | FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | Fe与盐酸反应制H2:2Fe+6H+═2Fe3++3H2↑ |
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 L CCl4中含有的分子数目为0.25NA | |
| B. | 标准状况下,体积为22.4L的物质所含微粒数是NA | |
| C. | 常温常压下,0.5 mol NH3中含有的原子数目为2NA | |
| D. | 500mL1 mol•L-1 K2SO4溶液中含有的k+数目为2NA |
20.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、Cl-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
1.甲醇是21世纪应用最广泛的清洁燃料之一,通过下列反应可以制备甲醇:CO(g)+2H2(g)?CH3OH (l)△H
(1)已知:
计算上述反应的△H=-128.1 kJ•mol-1.
(2)在容积可变的密闭容器中充入1mol CO(g) 和2molH2(g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
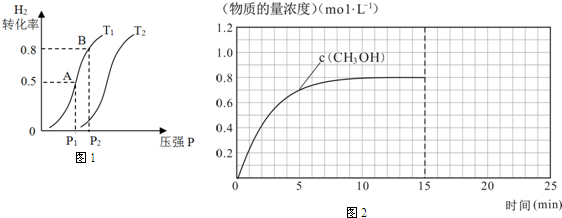
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4 L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度
B.从平衡体系中及时分离CH3OH
C.充入He
D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图中画出15-25分钟c(CO)的变化曲线.
(1)已知:
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
(2)在容积可变的密闭容器中充入1mol CO(g) 和2molH2(g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.

①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4 L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度
B.从平衡体系中及时分离CH3OH
C.充入He
D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO( g )和6molH2( g )生成CH3OH( g ),反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率为0.16mol•L-1•min-1;若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图中画出15-25分钟c(CO)的变化曲线.
18.利用下列实验装置能完成相应实验的是( )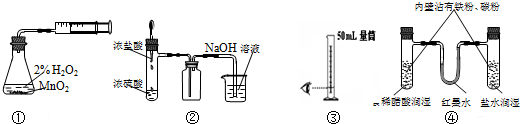

| A. | 装置①制取并收集纯净的氧气 | B. | 装置②制取并吸收HCl | ||
| C. | 装置③量取8.5mL的稀硫酸 | D. | 装置④模拟铁的腐蚀 |