题目内容
14.铝,铁,铜是生活中常用的金属.(1)工业上,用铝热法冶炼锰等金属,等质量的铝分别与V2O5、MnO2、Cr2O3反应,生成金属的物质的量最多的是Cr2O3(填化学式).
(2)Fe2O3、Cu2O都是红色粉未,将氧化铁溶于氢碘酸溶液中,滴加淀粉溶液,溶液变蓝色,写出离子方程式:Fe2O3+2I-+6H+═2Fe2++3H2O+I2;氧化亚铜溶于稀硫酸,溶液变蓝色,有红色固体生成,红色固体是Cu2O+2H+=Cu+Cu2++H2O.
(3)科学家建议利用铁粉、铝粉除去碱性水中NO3
①在碱性条件下铝粉将NO3-还原成N2,本身生成AlO2-.若将该反应设计成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O.②活性铁粉在碱性条件下,能将NO3-还原成NH3•H2O,本身被氧化成Fe3O4,写出离子方程式3Fe+NO3-+3H2O=NH3•H2O+Fe3O4+OH-.
(4)铁器表面镀一层金属可以提高耐腐蚀性,镀层金属可能是铜.
(5)利用废铜屑与浓硫酸反应制备硫酸铜,反应一段时间后,硫酸未反应完,但反应停止.为了使反应继续进行,从产品纯度、环保角度考虑,宜加入(或通入)试剂是ABD(填代号)(可加热)
A.Fe2O3 B.H2O2 C.KNO3 D.空气
(6)氧化铜有弱氧化性,赤热的氧化铜能氧化乙醇.乙二醇(HOCH2CH2OH)与赤热的氧化铜反应生成乙二醛(OHC-CHO),还原产物可能是Cu.(填化学式)
分析 (1)每消耗1mol铝能够提供3mol电子,根据电子守恒,各金属氧化物只能得到3mol电子,金属的化合价越低,产生的金属单质物质的量越多;
(2)氧化铁溶于氢碘酸,滴加淀粉溶液,溶液变蓝色,说明碘离子化合价升高,有碘单质产生,氧化铁中+3价铁的化合价降到+2价;氧化亚铜溶于稀硫酸,溶液变蓝色,说明产生二价铜离子,有红色固体生成,说明产生单质铜;
(3)①铝作负极,失电子在碱性条件下产生AlO2-;
②活性铁粉在碱性条件下,能将NO3-还原成NH3•H2O,本身被氧化成Fe3O4,根据得失电子守恒、电荷守恒、原子守恒写出离子方程式;
(4)铁器表面镀一层性质不活泼的金属可以提高耐腐蚀性;
(5)废铜屑与浓硫酸反应制备硫酸铜,浓硫酸变稀后反应停止,为了使反应继续进行,可加氧化剂将铜氧化成+2价,实现硫酸铜的制备,反应过程中不能产生有毒气体;
(6)氧化铜与乙醇反应生成铜和乙醛,氧化铜中铜元素的化合价降低,单质铜是还原产物,则类推乙二醇与氧化铜反应的还原产物.
解答 解:(1)每消耗1mol铝能够提供3mol电子,根据电子守恒,各金属氧化物只能得到3mol电子,金属的化合价越低,产生的金属单质物质的量越多,
V2O5→V,化合价变从+5变为0;MnO2→Mn,化合价由+4变为0;Cr2O3→Cr,化合价由+3变为0,则生成金属物质的量最多的是Cr2O3,
故答案为:Cr2O3;
(2)氧化铁溶于氢碘酸,滴加淀粉溶液,溶液变蓝色,说明碘离子化合价升高,有碘单质产生,氧化铁中+3价铁的化合价降到+2价,离子方程式为:Fe2O3+2I-+6H+═2Fe2++3H2O+I2;氧化亚铜溶于稀硫酸,溶液变蓝色,说明产生二价铜离子,有红色固体生成,说明产生单质铜,氧化亚铜在稀硫酸中发歧化反应的方程式为:Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Fe2O3+2I-+6H+═2Fe2++3H2O+I2;Cu2O+2H+=Cu+Cu2++H2O;
(3)①铝作负极,失电子在碱性条件下产生AlO2-,电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
②活性铁粉在碱性条件下,能将NO3-还原成NH3•H2O,氮的化合价降低8价,铁本身被氧化成Fe3O4,铁的化合价升高$\frac{8}{3}$价,则Fe与NO3-计量数之比为3:1,根据电荷守恒、原子守恒配平离子方程式为:3Fe+NO3-+3H2O=NH3•H2O+Fe3O4+OH-,故答案为:3Fe+NO3-+3H2O=NH3•H2O+Fe3O4+OH-;
(4)铁器表面镀一层性质不活泼的金属可以提高耐腐蚀性,比如铁上镀铜等,故答案为:铜;
(5)废铜屑与浓硫酸反应制备硫酸铜,浓硫酸变稀后反应停止,为了使反应继续进行,可加氧化剂将铜氧化成+2价,
A.Fe2O3 与稀硫酸反应:产生三价铁离子,三价铁离子与铜反应产生二价铜离子,故A正确;
B.H2O2与铜在酸性条件下直接将铜氧化成铜离子,故B正确;
C.铜、硝酸根、氢离子可发生反应生成铜离子,同时硝酸根被还原成一氧化氮气体,污染环境,故C错误;
D.通入空气并加热,铜与氧气反应生成氧化铜,氧化铜与稀硫酸反应生成铜离子,故D正确;
故答案为:ABD;
(6)氧化铜与乙醇反应生成铜和乙醛,氧化铜中铜元素的化合价降低,单质铜是还原产物,则乙二醇与氧化铜反应的还原产物为铜,氧化产物是乙二醛,
故答案为:Cu.
点评 本题考查常见金属元素的单质及其化合物的综合应用,涉及铝热反应、氧化还原反应的计算及离子方程式的书写等,注意氧化还原反应中得失电子守恒、离子守恒、原子守恒的应用,难度中等.

| A. | 标准状况下,5.6 L CCl4中含有的分子数目为0.25NA | |
| B. | 标准状况下,体积为22.4L的物质所含微粒数是NA | |
| C. | 常温常压下,0.5 mol NH3中含有的原子数目为2NA | |
| D. | 500mL1 mol•L-1 K2SO4溶液中含有的k+数目为2NA |
 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )| A. | NaOH | B. | H2SiO3 | C. | HNO2 | D. | H2SO4 |
| A. | 时快时慢 | B. | 先慢后快 | C. | 先快后慢 | D. | 保持不变 |
| A. | pH=7的溶液中可能大量存在Fe3+、Cl-、Na+、S2- | |
| B. | 1 mol/L的FeCl3溶液滴入沸水中,得到分散质颗粒数为NA | |
| C. | 1 mol/L的Fe(NO3)2溶液中滴加盐酸,溶液变为黄色 | |
| D. | SO2与FeCl3溶液反应的离子方程式:2Fe3++SO2+4OH-=2Fe2++SO42-+2H2O |
 苯乙酸
苯乙酸 .
.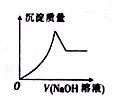 某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验:
某水溶液X中只可能含有Al3+、CO32-、Cl-、SiO32-、SO42-、Fe2+中的若干种离子.某同学对该溶液进行了如下实验: