题目内容
2.下列物质能氧化成醛的是( )| A. | CH3CHOHCH3 | B. | CH2OHCH2CH3 | C. | (CH3)2COHCH3 | D. | (CH3)3COH |
分析 选项中均为醇,与-OH相连C上有2个H可氧化成醛,与-OH相连C上有1个H可氧化成酮,与-OH相连C上没有H不能发生催化氧化,以此来解答.
解答 解:A.CH3CHOHCH3中,与-OH相连C上有1个H,可氧化成酮,故A不选;
B.CH2OHCH2CH3中,与-OH相连C上有2个H可氧化成醛,故B选;
C.(CH3)2COHCH3中,与-OH相连C上没有H不能发生催化氧化,故C不选;
D.(CH3)3COH中,与-OH相连C上没有H不能发生催化氧化,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握醇的催化氧化结构特点为解答的关键,侧重分析与应用能力的考查,注意醇的性质及应用,题目难度不大.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
13.乙醇、乙二醇( )、甘油(
)、甘油( )分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
 )、甘油(
)、甘油( )分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )
)分别与足量金属钠作用,产生等量的氢气,则三种醇的物质的量之比为( )| A. | 6:3:2 | B. | 1:2:3 | C. | 3:2:1 | D. | 4:3:2 |
10.下列都属于二次能源的是( )
| A. | 电能、蒸汽 | B. | 氢能、风能 | C. | 原煤、石油 | D. | 地热能、潮汐能 |
17.下列有关化学用语使用正确的是( )
| A. | CH4分子的比例模型: | B. | NH3的电子式: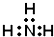 | ||
| C. | Ca2+的结构示意图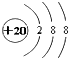 | D. | 次氯酸的结构式:H-Cl-O |
7.根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O═Cu(OH)2↓+H2↑.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.如表四组电极和电解液中,能实现该反应最为恰当的一组是( )
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
| 电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法中,错误的是( )
| A. | 元素周期表中,有18个纵行即有18个族 | |
| B. | 最外层电子数为2的元素原子,不一定属于ⅡA族元素 | |
| C. | 在周期表里,元素所在的周期序数等于原子核外的电子层数 | |
| D. | 副族与Ⅷ族元素都是金属元素 |
11. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
①该实验的目的是探究固体表面积、温度对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+Y?2Z
(2)从开始至2min,Z的平均反应速率为0.05mol/(L•min)
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
②实验Ⅰ和Ⅱ表明温度越高,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是Ⅱ和Ⅲ;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:在相同的温度下,采用相同状态的质量相同的锌片与两种体积相同但浓度不同的盐酸反应.