题目内容
7.根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O═Cu(OH)2↓+H2↑.但选择恰当电极材料和电解液进行电解,这个反应就能变为现实.如表四组电极和电解液中,能实现该反应最为恰当的一组是( )| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
| 电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 选择恰当电极材料和电解液进行电解,实现反应:Cu+2H2O=Cu(OH)2+H↑;利用电解原理使非自发进行的反应能进行反应,依据氧化还原反应的化合价变化,铜元素化合价升高失电子发生氧化反应,做电解池的阳极,水中的氢元素得到电子反应还原反应,在电解池的阴极上发生反应生成氢气.
解答 解:A、电解硫酸铜溶液,阳极上氢氧根离子失电子发生氧化反应,阴极上铜离子得到电子析出铜,2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,故A不符合;
B、阳极是铜失电子,阴极是溶液中氢离子得到电子发生还原反应,电池反应为Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑,故B不符合;
C、阳极是铜失电子,阴极是水电离的氢离子得到电子发生还原反应,电池反应为Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑,故C符合;
D、阳极是铜失电子,纯水中氢离子浓度很小,所以水的导电能力小,反应非常缓慢,故D不符合;
故选C.
点评 本题考查了电解原理的应用,利用电解原理实现氧化还原反应,需要分清阳极材料和电解质溶液组成,电极判断,电极反应是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列说法正确的是( )
| A. | 苯酚、乙酸、苯磺酸都有酸性,它们都属于酸 | |
| B. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种化合物组成元素相同,各元素质量分数相同,则两者一定是同分异构体 | |
| D. | CO(NH2)2是第一种人工合成的有机物,与氰酸铵(NH4CNO)是同分异构体 |
15.在NH4Al(SO4)2溶液中,逐滴滴入Ba(OH)2溶液,沉淀的物质的量随Ba(OH)2溶液体积的变化如图,有关分析正确的是( )

| A. | O~M段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 沉淀的质量M>P | |
| C. | N点溶液可与Na+、Fe3+、NO3-、Cl-大量共存 | |
| D. | N~P段溶液的pH逐渐减小 |
2.下列物质能氧化成醛的是( )
| A. | CH3CHOHCH3 | B. | CH2OHCH2CH3 | C. | (CH3)2COHCH3 | D. | (CH3)3COH |
12.下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )
| A. | 稀硫酸与锌粒反应生成气体 | B. | 浓硫酸使铁、铝钝化 | ||
| C. | 浓硫酸与铜反应加热反应产生SO2 | D. | 浓硫酸和木炭在加热条件下反应 |
19.关于人造丝和蚕丝的叙述不正确的是( )
| A. | 主要成分都是蛋白质 | B. | 都是高分子化合物 | ||
| C. | 可用灼烧的方法区别二者 | D. | 二者成分不同,但燃烧产物相同 |
16.某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据.表中数据为在不同条件下用10mL H2O2制取15OmLO2所需的时间(秒).
①上述实验结果体现了温度、催化剂、浓度等因素对过氧化氢分解速率的影响;
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快.
(2)某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示.根据图中数据.试填写下列空白:
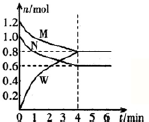
①该反应的化学方程式为M+N?2W.
②从开始至4min,N的平均反应速率为0.05mol/(L•min);4min 末M的转化率为33.3%.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据.表中数据为在不同条件下用10mL H2O2制取15OmLO2所需的时间(秒).
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率的影响温度升高化学反应速率加快;反应物浓度增大化学反应速率加快;使用合适的催化剂化学反应速率加快.
(2)某温度时,在一个2L的密闭容器中,M、N、W三种气体的物质的量随时间的变化曲线如图所示.根据图中数据.试填写下列空白:

①该反应的化学方程式为M+N?2W.
②从开始至4min,N的平均反应速率为0.05mol/(L•min);4min 末M的转化率为33.3%.
17.下列各组气体中均能造成大气污染的是( )
| A. | CO2、O2 | B. | N2、CO | C. | Cl2、N2 | D. | H2S、SO2 |
