题目内容
17.下列有关化学用语使用正确的是( )| A. | CH4分子的比例模型: | B. | NH3的电子式: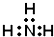 | ||
| C. | Ca2+的结构示意图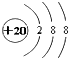 | D. | 次氯酸的结构式:H-Cl-O |
分析 A.比例模型主要体现出各原子的相对体积大小, 为球棍模型,不是比例模型;
为球棍模型,不是比例模型;
B.该电子式中漏掉了N原子的1对未成键电子对;
C.钙离子的核电荷数为20,核外电子总数为18,最外层满足8电子稳定结构;
D.次氯酸的中心原子为O原子,分子中不存在H-Cl键.
解答 解:A. 为比例模型,甲烷为正四面体结构,碳原子原子半径大于氢原子,甲烷的比例模型为:
为比例模型,甲烷为正四面体结构,碳原子原子半径大于氢原子,甲烷的比例模型为: ,故A错误;
,故A错误;
B.氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ,故B错误;
,故B错误;
C.Ca2+的核电荷数为20,最外层达到8电子稳定结构,其离子结构示意图为: ,故C正确;
,故C正确;
D.次氯酸分子中含有1个O-H键和1个O-Cl键,其正确的结构式为:H-O-Cl,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、比例模型与球棍模型、离子结构示意图、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题有利于培养学生的规范答题能力.

练习册系列答案
相关题目
7.工业上以锂辉石(Li2O•A12O3•4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:
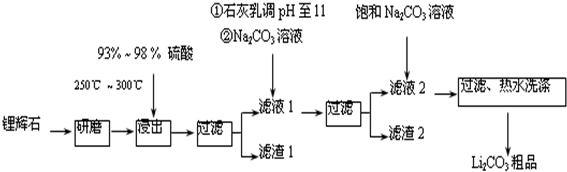
已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如表所示.
(1)从滤渣1中分离出Al2O3的部分流程如图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
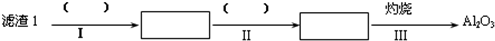
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.

已知:①Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250℃-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
②某些物质的溶解度(S)如表所示.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
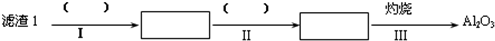
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释)增加Ca2+、OH-的浓度,有利于Mg(OH)2、CaCO3的析出.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是2C1--2e-=Cl2↑.
②b中,生成Li2CO3反应的化学方程式是2LiOH+NH4HCO3=Li2CO3+NH3+2H2O.
8.下列反应对应的离子方程式书写正确的是( )
| A. | 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| B. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH═Ca2++2CH3COO-+2H2O |
5.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 含NA个H的H2的物质的量为1 mol | |
| B. | NA个CO和1 mol N2所含分子数相等 | |
| C. | NA个H2SO4与1 mol H3PO4所含氢原子的个数比为1:1 | |
| D. | 0.1 mol C含1.2NA个质子 |
12.可逆反应H2(g)+I2(g)?2HI(g)达到平衡时的标志是( )
| A. | H2、I2、HI的浓度相等 | |
| B. | 混合气体密度恒定不变 | |
| C. | 混合气体的质量不再改变 | |
| D. | 1个I-I键断裂的同时,有2个H-I键断裂 |
2.下列物质能氧化成醛的是( )
| A. | CH3CHOHCH3 | B. | CH2OHCH2CH3 | C. | (CH3)2COHCH3 | D. | (CH3)3COH |
9.可逆反应 2A (气)+3B (气)?2C (气)+D(气)在四种不同条件下反应速率最快的是( )
| A. | v(D)=0.4 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.35 mol/(L•min) | D. | v(A)=0.5 mol/(L•min) |
7.下列叙述中正确的是( )
| A. | 在水溶液里或熔融状态下能够导电的物质叫做电解质 | |
| B. | 微粒直径在10-9 m-10-7m之间的分散系为胶体 | |
| C. | 能够电离出氢离子的化合物叫酸 | |
| D. | 胶体区别于其他分散系的本质特征是具有丁达尔效应 |