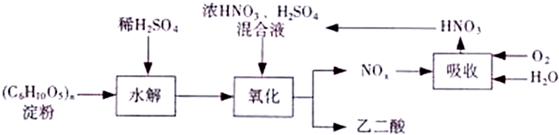
题目内容
13.某厂每天产生800m3含氮的废水(NH3的含量为168mg?L-1).该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg?L-1(假设废水处理前后体积不变).再对加热蒸发得到的NH3进一步处理制取硝酸.(1)制取硝酸过程中主要发生反应如下:①4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,②4NO+3O2+2H2O=4HNO3.反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式.
(2)该厂每天通过加热蒸发可得到NH3的物质的量是7200.
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
分析 (1)制取硝酸过程中主要发生反应有:①氨气的催化氧化,反应方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O; ②一氧化氮与氧气、水生成硝酸,反应方程式为:4NO+3O2+2H2O=4HNO3;
(2)计算氨气的浓度变化,进而计算生成氨气的质量,再根据n=$\frac{m}{M}$计算得到氨气的物质的量;
(3)由氮元素守恒可得关系式NH3~HNO3,据此计算.
解答 解:(1)制取硝酸过程中主要发生反应有:①氨气的催化氧化,反应方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
(2)氨气的浓度变化为168mg/L-15mg/L=153mg/L=0.153g/L,
m(NH3)=0.1536g/L×800m3×103L/m3=122400g,
n(NH3)=$\frac{122400g}{17g/mol}$=7200mol,
故答案为:7200mol;
(3)令生成硝酸的质量为x t,则:
NH3~~~~~HNO3,
17 63
1.224t×90% x t
所以,$\frac{17}{63}=\frac{1.224t×90%}{xt}$,解得x=0.41,
答:该厂每天可生产硝酸0.41t.
点评 本题考查溶液浓度计算、根据方程式计算的计算,难度中等,(3)注意利用关系式计算,简化计算过程.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
3.下列各项中的两个量,其比值一定为2:1的是( )
| A. | 在Na2SO4溶液中,c(Na+):c(SO42-) | |
| B. | 相同温度下,0.2 mol/L CH3COOH溶液中c(H+)与0.1 mol/LCH3COOH溶液中c(H+) | |
| C. | 在密闭容器中,反应N2(g)+3H2(g)?2NH3 (g)已达平衡时的c(NH3)与c(N2) | |
| D. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积 |
1.有5种溶液,他们分别是:①KNO3;②BaCl2;③NaOH;④(NH4)2SO4;⑤CuCl2,若要求不用任何外加试剂鉴别它们,则鉴别的先后顺序正确的是( )
| A. | ⑤④①③② | B. | ⑤③④②① | C. | ②④③①⑤ | D. | ③②④⑤① |
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 0.5mol?L-1K2SO4含有的K+数目为NA | |
| B. | 56g铁与足量的盐酸反应时失去电子的数目为3NA | |
| C. | 在标准状况下,22.4LCCl4中含有的分子数目为NA | |
| D. | 在常温常压下,16gO2和O3的混合气体所含原子数目为NA |
18.短周期主族元素X,Y,Z,W,Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
2.下列关于甲、乙、丙、丁四种装置的有关用法,其中不合理的是( )
| A. | 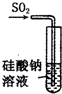 装置:可证明H2SiO3酸性与H2SO3酸性强 | |
| B. |  装置:橡胶管的作用是能使水顺利流下 | |
| C. | 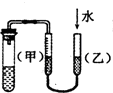 装置:用图示的方法能检查此装置的气密性 | |
| D. | 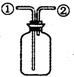 装置:可在瓶中先装入某种液体收集NO气体 |
3.为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是( )
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | NaCl溶液(CuCl2) | 钠 | 结晶 |
| B | S02(SO3) | NaOH溶液 | 萃取 |
| C | Cu(NO3)2溶液(AgNO3) | 铜粉 | 分液 |
| D | 乙醇(水) | … | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
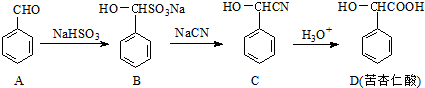
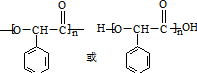
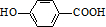 .
.