题目内容
5.乙二酸(H2C2O4)是一种重要的化工产品.可以使酸性高锰酸钾溶液褪色,自身被氧化为CO2.乙二酸制备工艺流程如图: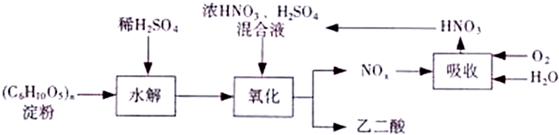
氧化时控制反应液温度为55-60℃边搅拌边缓慢滴加浓HNO3,H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案中用到的试剂为取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热,若有砖红色沉淀产生,说明含有葡萄糖.
(2)氧化时需控制反应液温度为55-60℃,不能超过60℃的原因是温度过低反应过慢,若温度过高硝酸会分解(或挥发).
(3)H2C2O4能使酸性KMnO4溶液褪色,其离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O.
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2):n(NO)=1:2,且NOx的吸收转化率为90%.计算:理论上,每生产6.3kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克.(写出计算过程)
分析 (1)葡萄糖含有醛基,取氧化后所得溶液,加入过量NaOH溶液,加入新制Cu(OH)2,加热,检验葡萄糖;
(2)若温度过低反应过慢,若温度过高硝酸会分解(或挥发);
(3)H2C2O4与酸性KMnO4溶液发生氧化还原反应生成二氧化碳、锰离子等,使溶液褪色;
(4)根据n=$\frac{m}{M}$计算乙二酸的物质的量,令反应生成NO2的乙二酸的物质的量为xmol,则反应生成NO的乙二酸的物质的量为(100-x)mol,根据方程式计算生成气体的物质的量,由氮元素守恒可知,损失的气体的物质的量等于需要补充的硝酸的物质的量,据此解答.
解答 解:(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为:取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热,若有砖红色沉淀产生,说明含有葡萄糖,
故答案为:取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热,若有砖红色沉淀产生,说明含有葡萄糖;
(2)温度过低反应过慢,若温度过高硝酸会分解(或挥发),故氧化时控制反应液温度为55~60℃,
故答案为:温度过低反应过慢,若温度过高硝酸会分解(或挥发);
(3)H2C2O4与酸性KMnO4溶液发生氧化还原反应生成二氧化碳、锰离子等,反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O;
(4)6.3kg乙二酸的物质的量为$\frac{6300g}{90g/mol}$=70mol,令反应生成NO2的乙二酸的物质的量为xmol,则反应生成NO的乙二酸的物质的量为(70-x)mol,由方程式可知,反应生成的n(NO2)=6x mol,n(NO)=2(70-x)mol,尾气NOx中n(NO2):n(NO)=1:2,故6x:2(70-x)=1:2,解得x=10,故需要补充硝酸为[6x+2(70-x)]mol×(1-90%)=[60+120]mol×(1-90%)=18mol,故需要加入硝酸溶液的质量为$\frac{18mol×63g/mol}{63%}$=1800g=1.8kg,
答:需要加入硝酸溶液的质为1.8kg.
点评 本题以乙二酸的制备为载体,考查糖类性质、实验条件的控制、化学计算等,难度中等,(4)关键是根据氮元素守恒判断损失的气体的物质的量等于需要补充的硝酸的物质的量.

| A. | PO43- | B. | CCl4 | C. | NO3- | D. | SiH4 |
| A. | 金属钠着火时,立即用水灭火 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处走 |
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A |  | NaOH | NaHCO3 | Na2CO3 | CO2 |
| B | C | CO | CO2 | O2 | |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
| D | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | 已知氢气的燃烧热为285.8kJ/mol,相应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g),△H=-285.8 kJ/mol | |
| B. | 中和相同体积、相同物质的量浓度的①硫酸,②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3 | |
| C. | 稀氨水中部分粒子的浓度大小关系:c(NH3•H2O)>c(OH-)>c(NH${\;}_{4}^{+}$)>c(H+) | |
| D. | 1mol/LNaX和1mol/LNaY两种盐溶液中c(X-)═c(Y-)+c(HY),则HX为强酸 |
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D.溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(O{H}^{-})}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是AD
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.Na2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
| A. | Fe(OH)3;Fe2O3 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)3Fe(OH)2;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.