题目内容
4.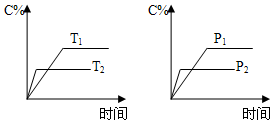 可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )| A. | 达到平衡后,加入催化剂,C的体积分数增大 | |
| B. | 达到平衡后,升高温度,平衡向左移动 | |
| C. | 化学方程式中,b>c+d | |
| D. | 达到平衡后,增加A的量,平衡向右移动 |
分析 可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图象(1)可知T2>T1,温度越高,平衡时C的体积分数φ(C)越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短.由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即b<c+d,据此结合外界条件对化学平衡的影响分析解答.
解答 解:A、达到平衡后,加入催化剂,平衡不移动,C的体积分数不变,故A错误;
B、正反应为放热反应,达到平衡后,升高温度,平衡向逆向移动,故B正确;
C、由图(2)可知p2>p1,压强越大,平衡时C的体积分数φ(C)越小,可知正反应为气体物质的量增大的反应,即b<c+d,故C错误;
D、A为固体,增加固体的量,平衡不移动,故D错误;
故选B.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意根据图象判断外界条件对平衡的移动的影响是解答该题的关键.

练习册系列答案
相关题目
15.已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是( )
| A. | 16g | B. | 32 | C. | 64g/mol | D. | 32g/mol |
19.下列有关化学实验基本知识的描述不正确的是( )
| A. | 丁达尔现象可用于区别FeCl3饱和溶液和Fe(OH)3胶体 | |
| B. | 称量时称量物放在称量纸上或玻璃器皿中,置于托盘天平右盘,砝码放在托盘天平的左盘中 | |
| C. | 汽油和水的混合物可用分液的方法分离 | |
| D. | 过滤和蒸发操作中均用到玻璃棒,但玻璃棒的作用不相同 |
9.需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 480mL,56.2g | B. | 500mL,56.2g | C. | 500mL,58.5g | D. | 任意规格,56.2g |
16.下面有关Na2CO3与NaHCO3的说法,错误的是( )
| A. | NaHCO3俗名小苏打 | |
| B. | 在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 | |
| D. | 热稳定性:NaHCO3<Na2CO3 |
13.下列关于溶液的配制说法不正确的是( )
| A. | 将质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸要用容量瓶配制 | |
| B. | 配制100mL1mol/L的氢氧化钠溶液,称量固体质量为4.0g | |
| C. | 容量瓶在定容时,若视线仰视,会使得配制出的溶液物质的量浓度偏小 | |
| D. | 容量瓶洗涤时,若瓶底上有少量蒸馏水,可不必烘干直接使用 |
 元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题: