题目内容
13.下列关于溶液的配制说法不正确的是( )| A. | 将质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸要用容量瓶配制 | |
| B. | 配制100mL1mol/L的氢氧化钠溶液,称量固体质量为4.0g | |
| C. | 容量瓶在定容时,若视线仰视,会使得配制出的溶液物质的量浓度偏小 | |
| D. | 容量瓶洗涤时,若瓶底上有少量蒸馏水,可不必烘干直接使用 |
分析 A.98%的浓硫酸稀释成质量分数为20%的稀硫酸,由稀释前后溶质的质量不变计算后,在烧杯中稀释即可;
B.结合m=cVM计算;
C.视线仰视,V偏大,结合c=$\frac{n}{V}$判断;
D.容量瓶洗涤时,若瓶底上有少量蒸馏水,对实验无影响.
解答 解:A.98%的浓硫酸稀释成质量分数为20%的稀硫酸,由稀释前后溶质的质量不变计算后,在烧杯中稀释即可,不需要容量瓶,故A错误;
B.配制100mL1mol/L的氢氧化钠溶液,称量固体质量为0.1L×1mol/L×40g/mol=4.0g,故B正确;
C.视线仰视,V偏大,由c=$\frac{n}{V}$可知,使得配制出的溶液物质的量浓度偏小,故C正确;
D.容量瓶洗涤时,若瓶底上有少量蒸馏水,对实验无影响,可不必烘干直接使用,故D正确;
故选A.
点评 本题考查配制一定浓度的溶液,为高频考点,把握溶液配制的步骤、误差分析、实验技能为解答的关键,侧重分析与实验能力的考查,注意仪器的使用,题目难度不大.

练习册系列答案
相关题目
3.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
| A. | SO2+2NaOH═Na2SO3+H2O | B. | 3NO2+2H2O═2HNO3+NO | ||
| C. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | D. | 2Na+2H2O═2NaOH+H2↑ |
4.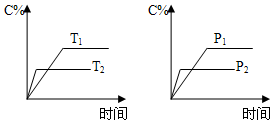 可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
 可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )| A. | 达到平衡后,加入催化剂,C的体积分数增大 | |
| B. | 达到平衡后,升高温度,平衡向左移动 | |
| C. | 化学方程式中,b>c+d | |
| D. | 达到平衡后,增加A的量,平衡向右移动 |
8.下列关于煤、石油综合利用的说法正确的是( )
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 石油裂化获得的产品是混合物 | |
| C. | 石油主要含C、H、O三种元素 | |
| D. | 煤焦油经过分馏可得到苯、甲苯等,说明煤中含有苯和甲苯 |
18.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L.下列说法正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |
5.向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同条件下(温度为T),发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是( )
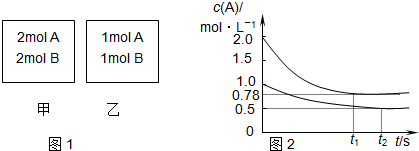

| A. | x=1 | |
| B. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 | |
| C. | 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中:0.78 mol•L-1<c(A)<1.56 mol•L-1 | |
| D. | 若甲容器为等压可变容器,向甲中充入惰性气体,则c(A)减小,平衡正向移动,v(正)、v(逆)减 |
3.设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 1 mol/L的CH3COOH中CH3COO-的浓度小于1 mol/L,而1 mol/L CH3COONa中CH3COO-等于1 mol/L | |
| D. | 18g 18O2中含有的中子数为10NA |
4.下列有关化学键与晶体结构说法正确的是( )
| A. | 两种元素组成的分子一定只有极性键 | |
| B. | 非金属元素组成的化合物一定是共价化合物 | |
| C. | 对于组成结构相似的分子晶体,相对分子质量越大,熔沸点一定越高 | |
| D. | 含阴离子的化合物一定有阳离子 |
