题目内容
14.含有相同氧原子数的CO和CO2,其物质的量比为2:1,质量比为14:11.分析 根据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$结合物质的构成计算.
解答 解:CO分子含有1个氧原子,CO2分子含有2个氧原子,氧原子数目相同,则n(CO)=2n(CO2),
故n(CO):n(CO2)=2:1,
m(CO):m(CO2)=2×28:1×44=14:11,
故答案为:2:1,14:11.
点评 本题考查物质的量的有关计算,为高频考点,把握质量、体积、物质的量、微粒数的关系为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
4.能正确表示下列反应的离子方程式的是( )
| A. | Fe3O4溶于足量稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 将过量的SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将0.2mol•L-1NH4HCO3溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓ |
5.关于如图所示①、②两个装置的叙述中,正确的是( )
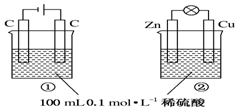

| A. | 硫酸浓度变化:①增大,②减小 | |
| B. | 装置名称:①是原电池,②是电解池 | |
| C. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑②中正极:Zn-2e-═Zn2+ | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
9.下列叙述正确的是( )
| A. | 2 mol H2O的质量为36g/mol | B. | CH4的摩尔质量16 | ||
| C. | 3.01×1023个SO2分子的质量为32g | D. | 1 mol任何物质体积均为22.4L |
19.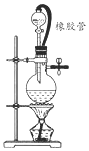 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |
6.为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合物中加入某些物质,下列判断不正确的是( )
| A. | 加入少量NaCl固体,v(H2)不变 | B. | 加入少量水,v(H2)减小 | ||
| C. | 加入少量CH3COONa固体,v(H2)不变 | D. | 加入少量CuSO4溶液,v(H2)变大 |
3.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
| A. | SO2+2NaOH═Na2SO3+H2O | B. | 3NO2+2H2O═2HNO3+NO | ||
| C. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | D. | 2Na+2H2O═2NaOH+H2↑ |
4.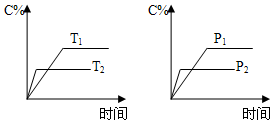 可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
 可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )
可逆反应aA(s)+bB(g)?cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( )| A. | 达到平衡后,加入催化剂,C的体积分数增大 | |
| B. | 达到平衡后,升高温度,平衡向左移动 | |
| C. | 化学方程式中,b>c+d | |
| D. | 达到平衡后,增加A的量,平衡向右移动 |