题目内容
4.向一定量的Fe、Fe2O3的固体混合物中,加入300mL1mol•L-1的盐酸,恰好使混合物完全溶解,放出672mL(标准状况)的气体.向所得溶液中,加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此固体混合物,则能得到铁的质量是( )| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,
根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.3L×1mol/L=0.15mol,
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知:n(Fe)=n(FeCl2)=0.15mol,
所以得到铁的质量为:0.15mol×56g/mol=8.4g,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.分类是学习和研究化学物质的一种常用的科学方法,下列说法正确的是( )
| A. | 高锰酸钾中含有氧元素,属于氧化物 | |
| B. | 一氧化碳中含有碳元素,属于有机物 | |
| C. | 纯碱溶液显碱性,属于碱 | |
| D. | 绿矾的化学式为FeSO4•7H2O,属于纯净物 |
19.下列关于胶体的叙述中不正确的是( )
| A. | 丁达尔现象可用区别胶体与溶液 | |
| B. | 胶体不稳定,在一定条件下会发生聚沉 | |
| C. | 胶体粒子能通过半透膜,不能通过滤纸 | |
| D. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
9.在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
下列说法正确的是( )
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时,NO2的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |

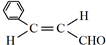 .
. .
. .
.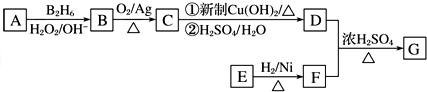
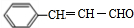 .
.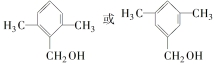 .
.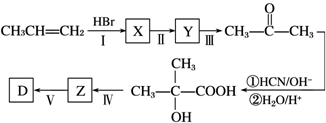
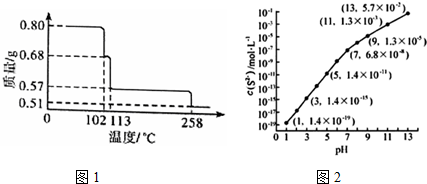
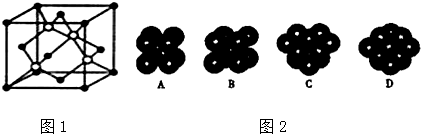
 检验氯仿是否被氧化应选用的试剂是
检验氯仿是否被氧化应选用的试剂是