题目内容
16.0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图1所示.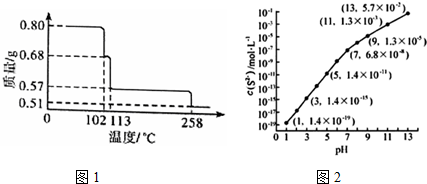
请回答下列问题:
(1)试确定200℃时固体物质的化学式CuSO4•H2O(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为CuSO4$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑,把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为CuSO4•5H2O,其存在的最高温度是102℃;
(3)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=2.2×10-8 mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是0.2 mol•L-1.
(4)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043 mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀,[已知:Ksp(MnS)=2.8×10-13].
分析 (1)由图分析可知,CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,根据相应的化学方程式即可确定此时固体物质的化学式;
(2)温度为570℃灼烧得到的黑色粉末是CuO,氧化性气体则为SO3,反应方程式为:CuSO4$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4•5H2O;根据图象分析其存在的最高102℃;
(3)根据溶度积常数进行计算c(Cu2+),根据溶液的电中性计算H+浓度;
(4)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH.
解答 解:(1)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
$\frac{250}{18n}=\frac{0.80g}{0.23g}$,
解得n=4,
200℃时该固体物质的化学式为CuSO4•H2O;
故答案为:CuSO4•H2O;
(2)温度为570℃灼烧得到的黑色粉末应是CuO,氧化性气体则为SO3,反应方程式为:CuSO4$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,
蒸发浓缩、冷却得到的晶体为CuSO4•5H2O;其存在的最高102℃.
故答案为:CuSO4$\frac{\underline{\;570℃\;}}{\;}$CuO+SO3↑; CuSO4•5H2O;102℃;
(3)根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH-)=10-6mol/L,Ksp[Cu(OH)2]=2.2×10-20,则c(Cu2+)=2.2×10-8mol•L-1;在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1mol•L-1,由电荷守恒可知c(H+)为0.2mol•L-1.
故答案为:2.2×10-8;0.2;
(4)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5.
点评 本题物质的含量计算及溶度积计算等,为高频考点,把握物质的性质、发生的反应及计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| B. | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | |
| C. | CH2=CH2+Br2→BrCH2-CH2Br | |
| D. |  |
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 无法计算 |
①CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=akJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=bkJ/mol
③2CO(g)+O2(g)?2CO2(g)△H3=ckJ/mol
(1)求反应CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=a+2b-2c kJ/mol(用含a、b、c的代数式表示).
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为3CO+3H2═CH3OCH3+CO2.
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:
CO2(g)+CH4(g)?CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图1所示,回答下列问题:
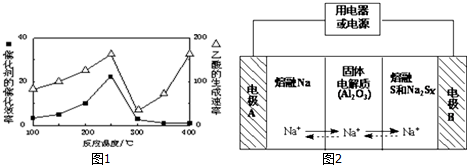
①250~300℃时,乙酸的生成速率降低的原因是催化剂的催化效率降低,化学反应速率降低.
②300~400℃时,乙酸的生成速率升高的原因是温度升高,化学反应速率加快.
(4)钠硫电池以熔融金属钠、熔融S和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图2所示:Na2SX $?_{放电}^{充电}$2Na+xS (3<x<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL0.2mol/LNaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3g.(假设电解前两极的反应物的质量相等)
| A. | 甲的命名主链选择是错误的 | B. | 乙的命名正确 | ||
| C. | 丙的命名主链选择是正确的 | D. | 丁的命名正确 |
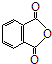
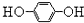 1,4一二羟基蒽醌结构简式
1,4一二羟基蒽醌结构简式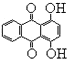
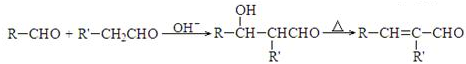
 .
. .
.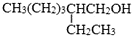 )反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线.
)反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线.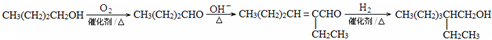 .
.
 制取氢氧化铁胶体
制取氢氧化铁胶体