题目内容
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ?mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
.燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: .
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 .
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
2H2S(g)=2H2(g)+S2(g)△H=+169.8kJ?mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为
考点:化学平衡的计算,热化学方程式
专题:化学平衡专题
分析:(1)利用盖斯定律解答,从待求反应出发分析反应物生成物在所给反应中的位置,通过相互加减可得;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;结合反应化学方程式电子守恒计算电子转移;
(3)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率.
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;结合反应化学方程式电子守恒计算电子转移;
(3)①“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
②根据一氧化碳的平衡浓度计算平衡时一氧化碳的物质的量,再根据转化率公式计算其转化率.
解答:
解:(1)CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1 ②
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1;
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,燃烧生成的SO2与H2S反应生成H2O和S2,反应的化学方程式为:4H2S+2SO2═4H2O+3S2:
故答案为:为H2S热分解反应提供热量;4H2S+2SO2═4H2O+3S2;
(3)①根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,故选Ⅰ;
②平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
×100%=80%,故答案为:80%.
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=247.4kJmol-1 ②
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=165.0kmol-1;
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,燃烧生成的SO2与H2S反应生成H2O和S2,反应的化学方程式为:4H2S+2SO2═4H2O+3S2:
故答案为:为H2S热分解反应提供热量;4H2S+2SO2═4H2O+3S2;
(3)①根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,故选Ⅰ;
②平衡时剩余一氧化碳的物质的量=0.2mol/L×2L=0.4mol,一氧化碳的转化率=
| (2-0.4)mol |
| 2mol |
点评:本题考查“原子经济性”概念的理解、热化学方程式的书写、物质的转化率等,熟练掌握基础是关键,难度中等.

练习册系列答案
相关题目
下列离子在水溶液中能大量共存的是( )
| A、Ca2+、K+、Cl-、CO32- |
| B、Ba2+、Cl-、K+、SO42- |
| C、Fe3+、Cl-、K+、NO3- |
| D、Ag+、NO3-、K+、Cl- |
现有四组混合物:①含有水分的植物油;②碘的CCl4溶液;③混有沙子的食盐水溶液;④氯化钠和单质碘的水溶液.分离以上各混合液的正确方法依次是( )
| A、分液、蒸馏、过滤、萃取 |
| B、萃取、蒸馏、分液、蒸馏 |
| C、分液、萃取、过滤、萃取 |
| D、蒸馏、萃取、过滤、分液 |
下列溶液中各微粒的浓度关系正确的是( )
| A、醋酸钠中加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
| C、1.0 mol?L -1Na2CO3溶液:c(OH-)=2c(HCO3-)+c(H+)+c(H2CO3) |
| D、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl |
水的电离过程为H2O?H++OH-,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是( )
| A、水的电离度α(25℃)>α(35℃) |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离过程是吸热过程 |
反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
| A、υ(D)=0.4 mol/(L?s) |
| B、υ(C)=0.6mol/(L?s) |
| C、υ(B)=0.5mol/(L?s) |
| D、υ(A)=0.15 mol/(L?s) |
有按如下特点排列的一系列(n种)稠环芳香烃:
①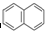 ②
② ③
③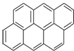 ④
④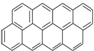 …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )
①
 ②
② ③
③ ④
④ …该系列化合物中所含碳的质量分数最大值是( )
…该系列化合物中所含碳的质量分数最大值是( )| A、93.8% | B、95.7% |
| C、97.3% | D、无法确定 |
标准状况下,VLHCl气体溶解在amL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,下列表达正确的是( )
A、溶质的质量分数ω=
| ||
B、溶质的物质的量浓度c=
| ||
C、溶液的密度ρ=
| ||
| D、取题中所述溶液10mL,再加入等体积水后,所得溶液的质量分数等于0.5ω |
 (1)维生素C的结构简式是
(1)维生素C的结构简式是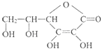 ,维生素C的分子式是
,维生素C的分子式是