题目内容
12.NA为阿伏伽德罗常数的值.下列说法错误的是( )| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下CH3COONH4溶液pH=7,1L 0.1mol•L-1该溶液中NH4+离子数为0.1NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量NaOH溶液中水解得到乙醇分子数为NA |
分析 A、H2O与CH2D2的摩尔质量均为18g/mol,且均含10个质子;
B、铵根离子为弱碱阳离子,在溶液中会水解;
C、求出NO2的物质的量,然后根据3molNO2和水反应转移2mol电子来分析;
D、酯类在碱溶液中的水解能进行彻底.
解答 解:A、H2O与CH2D2的摩尔质量均为18g/mol,故等物质的量的两者的物质的量相同,且两者均含10个质子,故等物质的量的两种物质中的质子数相同,故A正确;
B、铵根离子为弱碱阳离子,在溶液中和醋酸根发生双水解,故溶液中的铵根离子的个数小于0.1NA个,故B错误;
C、标况下6.72LNO2的物质的量为0.3mol,而3molNO2和水反应转移2mol电子,故0.3molNO2和水反应转移0.2NA个电子,故C正确;
D、酯类在碱溶液中的水解能进行彻底,故1mol乙酸乙酯水解能生成1mol乙醇,即NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| C. | 常温常压下,3.2gO2和3.2gO3中所含氧原子数都是0.2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体的温度降至标准状况,其体积约为22.4L |
3.下列物质中含有共价键的离子化合物是( )
| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | HCl |
20.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
7. 下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
( )
 下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)| 甲 | 乙 | 丙 | 戊 | |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
| D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
| A. | A | B. | B | C. | C | D. | D |
6.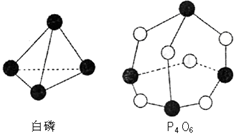 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )| A. | -1638kJ/mol | B. | +1638kJ/mol | C. | -126kJ/mol | D. | +126kJ/mol |
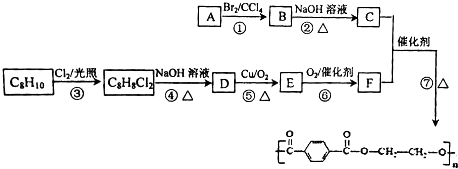
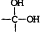 →
→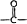 +H2O
+H2O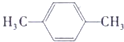 .
.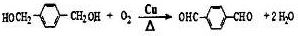 ;
;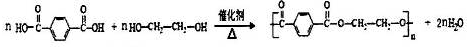 .
.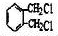 .
.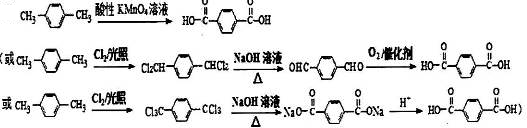 (有机物用结构简式表示,无机试剂任选).
(有机物用结构简式表示,无机试剂任选).



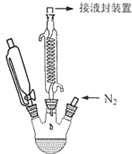 二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).
二茂铁的化学式为(C5H5)2Fe,它是一种橙黄色针状晶体,熔点173--174℃,100℃以上显著升华,沸点249℃,不溶于水,可溶于甲醇、乙醇、乙醚和苯等有机溶剂,可作高性能的火箭燃料添加剂.实验室制备二茂铁的反应原理为:8KOH+2C5H6+FeCl2•4H2O$\frac{\underline{\;\;△\;\;}}{\;}$(C5H5)2Fe+2KCl+6KOH•H2O实验装置如图所示(加热及磁力搅拌装置未画出).