题目内容
15.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列说法中正确的是( )| A. | 该现象说明了NaHCO3难溶于水 | |
| B. | 滤液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 滤液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
分析 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,溶液中含有NH4Cl,铵根离子水解导致溶液呈酸性,任何电解质溶液中都存在电荷守恒和物料守恒,结合电荷守恒和物料守恒分析解答.
解答 解:常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,溶液中含有NH4Cl,铵根离子水解导致溶液呈酸性,
A.碳酸氢钠易溶于水,析出碳酸氢钠晶体,说明碳酸氢钠的溶解度小于碳酸氢铵,故A错误;
B.NH4HCO3与NaCl的物质的量相等,由于碳酸氢根离子部分水解,则c(Na+)>c(HCO3-),由于碳酸氢根离子的电离程度小于其水解程度,则c(CO32-)<c(H2CO3),所以正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.溶液中存在电荷守恒:c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),故C错误;
D.溶液呈酸性,则>c(H+)>c(OH-),铵根离子部分水解,则c(Cl-)>c(NH4+),由于析出部分NaHCO3晶体,则HCO3-浓度减小,HCO3-的电离程度很小,所以c(CO32-)最小,即c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
5.下列说法正确的是( )
| A. | 实验室用Zn和稀硫酸制H2,为加快反应速率,可向稀硫酸中加入少量Cu粉 | |
| B. | CH3Cl(g)+Cl2(g)$\stackrel{光照}{→}$CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H>0 | |
| C. | 在一体积可变的恒温密闭容器中发生反应PCl3(g)+Cl2(g)?PCl5(g),压缩体积,平衡正向移动,K值增大 | |
| D. | 25℃时Ka(HClO)=3.0×10-8,Ka(HCN)=4.9×10-10,若该温度下NaClO溶液与NaCN溶液pH相同,则c(NaClO)<c(NaCN) |
6.将1mol氨气和2mol氧气混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是( )
| A. | 二氧化氮与氧气 | B. | 一氧化氮与二氧化氮 | ||
| C. | 硝酸与一氧化氮 | D. | 硝酸与水 |
3.下列物质中含有共价键的离子化合物是( )
| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | HCl |
20.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
7. 下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
( )
 下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)| 甲 | 乙 | 丙 | 戊 | |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | CO2 |
| D | 乙醇乙酯 | NaOH溶液 | 乙醇 | 乙酸 |
| A. | A | B. | B | C. | C | D. | D |
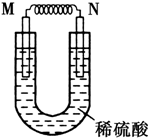 由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.
由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.


