题目内容
对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A、达到化学平衡时,4v正(O2)=5v逆(NO) |
| B、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C、达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动 |
| D、化学反应速率关系是:2v正(NH3)=3v正(H2O) |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A、化学反应达到平衡时,并且正逆反应速率相等,反应速率之比等于化学计量数之比是物质的正反应速率之比;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则只表明反应正向进行;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小;
D、学反应中反应速率之比等于化学计量数之比,根据化学方程式分析.
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则只表明反应正向进行;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小;
D、学反应中反应速率之比等于化学计量数之比,根据化学方程式分析.
解答:
解:A、化学反应中反应速率之比等于化学计量数之比,根据化学方程式可知4v正(O2)=5v正(NO),4v正(O2)=5v逆(NO),v正(NO)=v逆(NO),故A正确;
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则只表明反应正向进行,不能体现正逆反应速率相等,故B错误;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,故C错误;
D、化学反应中反应速率之比等于化学计量数之比,根据化学方程式可知3v正(NH3)=2v正(H2O)成立,故D错误;
故选A.
B、若单位时间内生成xmolNO的同时,消耗xmolNH3,则只表明反应正向进行,不能体现正逆反应速率相等,故B错误;
C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,故C错误;
D、化学反应中反应速率之比等于化学计量数之比,根据化学方程式可知3v正(NH3)=2v正(H2O)成立,故D错误;
故选A.
点评:本题考查化学平衡问题,题目难度不大,本题中注意平衡状态的判断、化学反应速率之比的等于化学计量数之比的利用以及可逆反应的特点.

练习册系列答案
相关题目
通过NOx传感器可监测NOx的含量,其工作原理示意图如图,下列说法正确的是( )
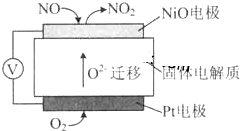

| A、NiO电极是该电池的正极 |
| B、Pt电极附近的pH增大 |
| C、NiO电极的电极反应式:NO-2e-+O2-═NO2 |
| D、固体电解质中O2-向正极移动 |
以下离子方程式的书写正确的是( )
| A、氧化铁和稀盐酸:FeO+2H+=Fe2++H2O |
| B、向NaOH溶液中通Cl2:2OH-+Cl2=Cl-+ClO-+H2O |
| C、向AlCl3溶液中加过量强碱:Al3++3OH-=Al(OH)3↓ |
| D、给漂白粉溶液中加入盐酸:Ca(ClO2)+2H+=2HClO+Ca2+ |
 难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)
难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(g)+2I2(g)| 1123K |
| 1023K |
| A、在不同温度区域,TaI4的量不同 |
| B、在提纯过程中,S2的量不断增多 |
| C、该反应的平衡常数不随TaI4和S2的浓度增大而增大 |
| D、在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
能使反应:Cu+2H2O=Cu(OH)2+H2发生的是( )
| A、铜片作阴、阳极,电解CuCl2 |
| B、铁片作正极,Cu片作负极,CuCl2作电解质溶液的原电池 |
| C、用铜片作阴、阳极,电解NaOH溶液 |
| D、铜锌合金在潮湿空气中发生电化学腐蚀 |
下列离子方程式书写正确的是( )
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
| B、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O | ||||
| C、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++2H++H2O2=2Fe3++2H2O | ||||
D、用惰性电极电解硫酸铜溶液:Cu2++2H+
|
下列各组微粒,在溶液中能大量共存的是( )
| A、K+、H+、NO3-、Cl- |
| B、Cu2+、Cl-、OH-、SO42- |
| C、H+、Na+、HCO3-、Cl- |
| D、Ca2+、Cl-、K+、CO32- |
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是( )
| A、电池总反应为Mg+H2O2═Mg(OH)2 |
| B、正极发生的电极反应为H2O2+2H++2e-═2H2O |
| C、工作时,正极周围海水的pH减小 |
| D、电池工作时,溶液中的H+向负极移动 |
 右图是铜与稀硝酸反应的实验装置图,请回答下列问题:
右图是铜与稀硝酸反应的实验装置图,请回答下列问题: