题目内容
12. 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.盐酸为强酸,完全电离,根据滴定前水溶液的pH分析;
B.V(NaOH)=20.00mL时恰好生成醋酸钠,醋酸根离子水解溶液呈碱性,若为中性,加入的氢氧化钠溶液体积稍小;
C.此时两溶液都恰好反应分别生成NaCl和醋酸钠,醋酸根离子部分水解,醋酸根离子浓度减小;
D.该关系式中正电荷总浓度大于负电荷总浓度,违反了电荷守恒.
解答 解:A.滴定前0.100mol/L的盐酸溶液的pH为1,则曲线Ⅰ为滴定盐酸的曲线,故A错误;
B.V(NaOH)=20.00mL时恰好生成醋酸钠,溶液呈碱性,若pH=7,则加入的氢氧化钠溶液体积应该稍小,即V(NaOH)<20.00mL,故B错误;
C.V(NaOH)=20.00mL时两溶液恰好反应分别生成醋酸钠和NaCl,由于醋酸根离子发生水解,导致两份溶液中c(Cl-)>c(CH3COO-),故C正确;
D.V(NaOH)=10.00mL时,反应后溶质为等浓度的醋酸和醋酸钠,由于醋酸的水解程度大于醋酸根离子的水解程度,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及综合应用能力.

练习册系列答案
相关题目
3. 有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
 有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )
有机物A与B的分子式为C5H10O2,在酸性条件下均可水解,转化关系如图.下列有关说法中不正确的是( )| A. | X可以为丁酸,也可以为丙醇 | B. | C分子中的碳原子数最多为3个 | ||
| C. | C可能能发生银镜反应 | D. | X、Y互为同分异构体. |
7. 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
17.下列有关甲烷的说法不正确的是( )
| A. | 甲烷分子中四个碳氢键键长相等 | |
| B. | 甲烷分子中四个碳氢键键角相等 | |
| C. | 甲烷分子中四个碳氢键键能相等 | |
| D. | 由于甲烷分子三个键参数都分别相等,所以甲烷的空间构型是平面正方形结构 |

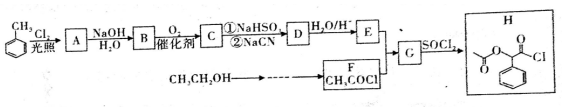

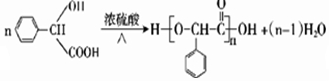 .
.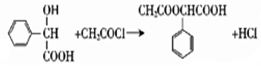 .
.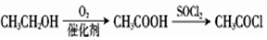 .
. .
. 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如图: