题目内容
9.如表是元素周期表的一部分,回答下列问题:| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的结构式H-O-H.
(4)比较⑤与⑥的化学性质,Na更活泼,试用实验证明(简述简单操作、主要现象和结论把钠镁分别投入冷水中,钠不断游动,不一会儿就消失,而镁无明显现象,故可知钠比镁活泼.
分析 根据各元素在周期表中的相对位置可知,①C为、②N元素、③O元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为Si元素、⑨为P元素、⑩为S元素、⑪为Cl元素、⑫为,Ar元素,
(1)同一周期,随着原子序数的递增,非金属性逐渐增强,同一主族,随着原子序数的递增,非金属性逐渐减弱;稀有气体最外层满足稳定结构,最不活泼;
(2)非金属性越强,最高价氧化物对应水合物酸性越强,F没有最高正价,则最高价含氧酸酸性最强的为Cl;能够与酸和碱反应的氢氧化铝为两性氢氧化物;
(3)同一周期元素,原子序数越大,原子半径越小;③为O元素,其氢化物为水,水分子为共价化合物,分子中存在两个氢氧键;
(4)⑤为Na元素、⑥为Mg元素,同一周期元素,原子序数越大,非金属性越小,可以通过金属与水反应的现象验证.
解答 解:根据各元素在周期表中的相对位置可知,①C为、②N元素、③O元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Al元素、⑧为Si元素、⑨为P元素、⑩为S元素、⑪为Cl元素、⑫为,Ar元素,
(1)11种元素中,非金属性最强的为F;稀有气体元素性质稳定,则最不活泼的元素为Ar,
故答案为:F;Ar;
(2)这些元素的最高价氧化物的对应水化物中酸性最强的元素为Cl,该酸为HClO4;11种元素,氢氧化物呈两性的为氢氧化铝,所以该元素为Al,
故答案为:HClO4;Al;
(3)从⑤到⑪的元素位于第三周期,同一周期,随着原子序数的递增,原子半径逐渐减小,则原子半径最小的为⑤Cl元素;③为O元素,形成的氢化物为水,水分子的结构式为:H-O-H,
故答案为:Cl; H-O-H;
(4)⑤为Na、⑥为Mg元素,金属性大小为:Na>Mg;验证方法为:把钠镁分别投入冷水中,钠不断游动,不一会儿就消失,而镁无明显现象,故可知钠比镁活泼,
故答案为:Na;把钠镁分别投入冷水中,钠不断游动,不一会儿就消失,而镁无明显现象,故可知钠比镁活泼.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,明确原子结构与元素周期表的关系为解答关键,注意掌握元素周期律内容,试题培养了学生的分析能力及灵活应用能力.

| A. | 0.04 | B. | 0.4 | C. | 0.01 | D. | 0.16 |
| A. | 0.03 mol | B. | 0.15 mol | C. | 0.05 mol | D. | 无法确定 |
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式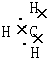 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体.
| A. | ①②⑤ | B. | ②③⑥ | C. | ②③④⑤ | D. | ②④ |
| A. | CH3COONa与CH3COOH混合溶液呈中性,则溶液中有c(CH3COO-)═c (Na+) | |
| B. | NaHCO3溶液中有:c (H+)+c (H2CO3)═c (OH-)+c (CO32-) | |
| C. | 物质的量浓度均为0.1 mol/L的Na2CO3和NaHCO3的混合溶液中有:c (Na+)>c (HCO3-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 常温下,p H为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,则HA为强酸BOH为弱碱 |
| A. | 苯(苯酚):加浓溴水,过滤 | |
| B. | 淀粉溶液(NaCl):半透膜,渗析 | |
| C. | 溴乙烷(乙醇):加蒸馏水,分液 | |
| D. | 乙酸乙酯(乙醇):加饱和碳酸钠溶液,分液 |
 ,关于它的叙述中正确的是( )
,关于它的叙述中正确的是( )| A. | 1mol该有机物最多能够和2molNaOH发生反应 | |
| B. | 和乙醇发生酯化反应时,羧基中的-OH将被CH3CH2-取代 | |
| C. | 铜做催化剂并加热的条件下,羟基中的氢氧键会断裂 | |
| D. | 和  互为同分异构体 互为同分异构体 |
 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O. +2nNaOH$→_{△}^{Cu}$n
+2nNaOH$→_{△}^{Cu}$n +n
+n .+nH2O.
.+nH2O.