题目内容
1.下列说法不正确的是( )| A. | CH3COONa与CH3COOH混合溶液呈中性,则溶液中有c(CH3COO-)═c (Na+) | |
| B. | NaHCO3溶液中有:c (H+)+c (H2CO3)═c (OH-)+c (CO32-) | |
| C. | 物质的量浓度均为0.1 mol/L的Na2CO3和NaHCO3的混合溶液中有:c (Na+)>c (HCO3-)>c (CO32-)>c (OH-)>c (H+) | |
| D. | 常温下,p H为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,则HA为强酸BOH为弱碱 |
分析 A.CH3COONa与CH3COOH混合溶液呈中性,c(H+)=c(OH-),结合溶液中电荷守恒分析判断;
B.NaHCO3溶液中存在物料守恒和电荷守恒,据此计算判断;
C.物质的量浓度均为0.1 mol/L的Na2CO3和NaHCO3的混合溶液中,碳酸钠水解程度大于大于碳酸氢钠;
D.常温下,p H为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,说明HA溶液中存在电离平衡;
解答 解:A.CH3COONa与CH3COOH混合溶液呈中性,c(H+)=c(OH-),溶液中电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液中有c(CH3COO-)═c (Na+),故A正确;
B.NaHCO3溶液中存在物料守恒c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),电荷守恒c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-),据此计算得到c (H+)+c (H2CO3)═c (OH-)+c (CO32-),故B正确;
C.物质的量浓度均为0.1 mol/L的Na2CO3和NaHCO3的混合溶液中,碳酸钠水解程度大于大于碳酸氢钠溶液显碱性,离子浓度大小c (Na+)>c (HCO3-)>c (CO32-)>c (OH-)>c (H+),故C正确;
D.常温下,p H为2的某酸HA与pH为12的某碱BOH等体积混合溶液呈酸性,说明HA溶液中存在电离平衡,证明酸一定为弱酸,故D错误;
故选D.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、盐类水解和弱电解质电离平衡的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
11.2015年10月5日,屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构如图)获得诺贝尔生理学或医学奖.一定条件下青蒿素可以转化为双氢青蒿素.下列有关说法中正确的是( )
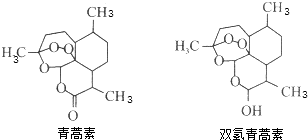

| A. | 青蒿素的分子式为C15H20O5 | |
| B. | 1 mol青蒿素最多能和1 molBr2发生加成反应 | |
| C. | 双氢青蒿素能发生氧化反应、酯化反应 | |
| D. | 青蒿素转化为双氢青蒿素发生了氧化反应 |
12.在自然界存在游离态的元素是( )
| A. | 硫 | B. | 氯 | C. | 铝 | D. | 镁 |
9.如表是元素周期表的一部分,回答下列问题:
(1)在这些元素中,F(用元素符号填写,下同)是最活泼的非金属元素;Ar是最不活泼的元素.
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的结构式H-O-H.
(4)比较⑤与⑥的化学性质,Na更活泼,试用实验证明(简述简单操作、主要现象和结论把钠镁分别投入冷水中,钠不断游动,不一会儿就消失,而镁无明显现象,故可知钠比镁活泼.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;能形成两性氢氧化物的元素是Al.
(3)从⑤到⑪的元素中,Cl原子半径最小,写出③形成的氢化物的结构式H-O-H.
(4)比较⑤与⑥的化学性质,Na更活泼,试用实验证明(简述简单操作、主要现象和结论把钠镁分别投入冷水中,钠不断游动,不一会儿就消失,而镁无明显现象,故可知钠比镁活泼.
16.化合物是一种取代有机氯农药DDT的新型杀虫剂,它含有几种官能团( )

| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
6.下列物质中,属于非电解质且形成水溶液能导电的是( )
| A. | 氯化钠 | B. | 蔗糖 | C. | SO3 | D. | 稀硫酸 |
10.聚氯乙烯简称PVC,是当今世界上产量最大、应用最广的热塑性塑料之一.下列说法正确的是( )
| A. | 聚氯乙烯的单体是CH3CH2Cl | |
| B. | 聚氯乙烯是高分子化合物 | |
| C. | 聚氯乙烯能够使溴的四氯化碳溶液褪色 | |
| D. | 聚氯乙烯保鲜膜最适合用来包装蔬菜、水果及熟食 |
11.下列物质中没有酸性的是( )
| A. | Al2O3 | B. | H2SO4 | C. | KClO3 | D. | NaHSO4 |