题目内容
13.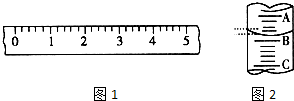 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
(3)配制0.5mol•L-1的硫酸溶液200mL所需的玻璃仪器为量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管.
分析 (1)用天平称量物体质量时,物质放在左盘中,砝码放在右盘中,先向右盘中大到小依次加减砝码,最后移动游码,小烧杯的质量为32.6g,所需要的砝码为:20+10,剩下的2.6g可通过移动游码去实现;
(2)量筒的刻度由下而上增大,精度为0.1;
(3)配制0.5mol•L-1的硫酸溶液200mL,所需的玻璃仪器为:量筒、200mL容量瓶、烧杯、玻璃棒、胶头滴管.
解答 解:(1)小烧杯的质量为32.6g,用托盘天平准确称其质量,先在右盘加入50g砝码,质量过大,表示为:50g↓↑;然后换20g砝码,砝码质量不足,表示为:20g↓;再加20g砝码,20g砝码质量过大,表示为:↓↑;换10g砝码,10g砝码质量不足,表示为:10g↓;再加5g砝码,5g砝码质量过大,拿下5g砝码,表示为:5g↓↑;最后移动游码到2.6g进行调平,在图1所示的游码尺上画出游码的位置为: ,
,
故答案为:
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
 ;
;(2)量筒的刻度由下而上增大,精度为0.1,读数时应取凹液面的最低点,因A与B,B与C刻度间相差1mL,则每一小格为0.2 mL,又A为4,则B为3,故图2读数为3.2mL,
故答案为:3.2;
(3)用量筒硫酸浓硫酸体积,在烧杯中溶解,并用玻璃棒搅拌,移入200mL容量瓶中,最后用胶头滴管定容,
故答案为:量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管.
点评 本题考查一定物质的量浓度溶液配制、天平使用、液体的量取等,试题基础性强,有利于培养学生的实验能力,注意腐蚀性易潮解的药品应放在玻璃器皿内称量.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
4.为了探究FeS04和Cu(N03)2的混合物中各组分的含量,现设计如下流程.下列叙述中错误的是( ) 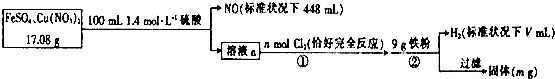

| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
1.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
8.电子工业制造光电管时,需要一种强光照射就失电子,从而接通电路的材料,制造该材料的物质是( )
| A. | 放射元素 | B. | ⅦA族元素 | C. | 卤化银 | D. | ⅠA族元素 |
18.下列离子方程式书写正确的是( )
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| B. | 向石灰石中滴加稀硝酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应2H2O-4e-═O2+4H+ | |
| D. | NaOH溶液中通入少量硫化氢气体:2OH-+H2S═S2-+2H2O |
5.A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍.请回答下列问题:
(1)W的最高价氧化物化学式是Cl2O7;Z 的原子结构示意图为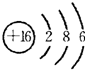 .
.
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂
c.将 X的简单气态氢化物及时移离 d.增大反应体系的压强
(5)标准状况下,2.24 L X的简单气态氢化物被200 mL 1 mol•L-1 X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-).
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用 WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
| X | Y | |
| Z | W |
 .
.(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂
c.将 X的简单气态氢化物及时移离 d.增大反应体系的压强
(5)标准状况下,2.24 L X的简单气态氢化物被200 mL 1 mol•L-1 X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-).
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用 WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
3.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O-→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3-→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
实验流程如下:
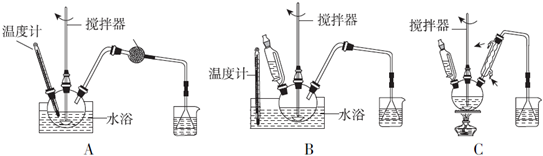
(1)第①步中溴水氧化葡萄糖时,下列装置中最适合的是B.
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.
C6H12O6(葡萄糖)+Br2+H2O-→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3-→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

(1)第①步中溴水氧化葡萄糖时,下列装置中最适合的是B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液.