题目内容
18.下列离子方程式书写正确的是( )| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| B. | 向石灰石中滴加稀硝酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应2H2O-4e-═O2+4H+ | |
| D. | NaOH溶液中通入少量硫化氢气体:2OH-+H2S═S2-+2H2O |
分析 A.二者反应生成碳酸钡、NaOH和水;
B.二者反应生成可溶性硝酸钙、二氧化碳和水;
C.用惰性电极电解KOH溶液时,阴极上水得电子生成氢气和氢氧根离子;
D.NaOH溶液中通入少量硫化氢气体生成硫化钠.
解答 解:A.二者反应生成碳酸钡、NaOH和水,离子方程式为Ba2++OH-+HCO3-=BaCO3↓+H2O,故A错误;
B.二者反应生成可溶性硝酸钙、二氧化碳和水,离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故B正确;
C.用惰性电极电解KOH溶液时,阴极上水得电子生成氢气和氢氧根离子,离子方程式为2H2O+4e-═H2↑+2OH-,故C错误;
D.NaOH溶液中通入少量硫化氢气体生成硫化钠,离子方程式为2OH-+H2S═S2-+2H2O,故D正确;
故选BD.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则是解本题关键,侧重考查氧化还原反应、复分解反应,注意AD产物与反应物的量有关,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
6.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
13.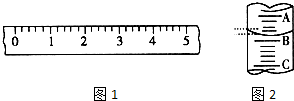 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(2)图2表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中的液体的体积是3.2mL.
(3)配制0.5mol•L-1的硫酸溶液200mL所需的玻璃仪器为量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管.
 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
(3)配制0.5mol•L-1的硫酸溶液200mL所需的玻璃仪器为量筒、烧杯、玻璃棒、200mL容量瓶、胶头滴管.
3.在标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为( )
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
10.实验室用铅蓄电池作电源电解饱和食盐水制取Cl2,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42--2e-═PbSO4
正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O
今欲制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42--2e-═PbSO4
正极:PbO2+4H++SO42-+2e-═PbSO4+2H2O
今欲制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
7.下列反应的离子方程式不正确的是( )
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
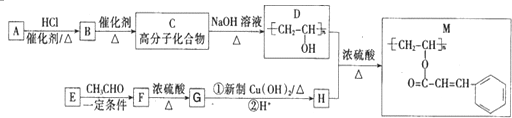
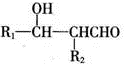
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).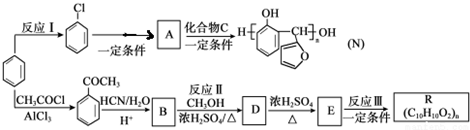
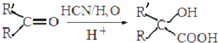
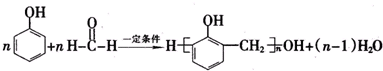
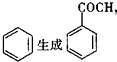 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•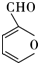
 .
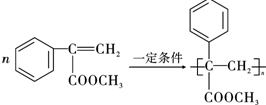
.
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题: