��Ŀ����
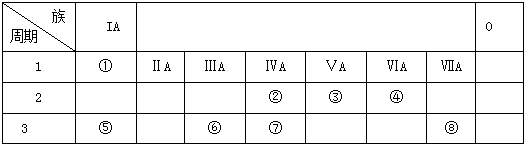
���ֶ�����Ԫ�������ڱ��е����λ��������ʾ������ZԪ��ԭ�Ӻ��������������������������3����
��1����д��Ԫ�����ƣ�W ��Ԫ��Z�����ڱ���λ�� ��
��2��Ԫ��X�����γɶ��ֵ��ʣ���������������Ʒֱ��� �����ǵĹ�ϵ��
��3��Y�����������Ļ�ѧʽΪ ������Ԫ�������������ˮ����������ǿ��ˮ�����ǣ���ѧʽ�� ��
��4��M�����ӽṹʾ��ͼ ��X��M�γɻ�����ĵ���ʽ ��
��5������Ԫ���а뾶��С��Ԫ�صķ����� ��
| X | Y | ||
| Z | W | M |
��2��Ԫ��X�����γɶ��ֵ��ʣ���������������Ʒֱ���
��3��Y�����������Ļ�ѧʽΪ
��4��M�����ӽṹʾ��ͼ
��5������Ԫ���а뾶��С��Ԫ�صķ�����
���㣺Ԫ�������ɺ�Ԫ�����ڱ����ۺ�Ӧ��
ר�⣺Ԫ����������Ԫ�����ڱ�ר��
�������ɶ�����Ԫ�������ڱ���λ�ã���֪X��Y���ڵڶ����ڣ�Z��W��M���ڵ������ڣ�ZԪ��ԭ�Ӻ��������������������������3����������������Ϊa����2+8+a=3a�����a=5����ZΪPԪ�أ�����֪XΪCԪ�ء�YΪNԪ�ء�WΪSԪ�ء�MΪClԪ�أ��ݴ˼��㣮
���
�⣺�ɶ�����Ԫ�������ڱ���λ�ã���֪X��Y���ڵڶ����ڣ�Z��W��M���ڵ������ڣ�ZԪ��ԭ�Ӻ��������������������������3����������������Ϊa����2+8+a=3a�����a=5����ZΪPԪ�أ�����֪XΪCԪ�ء�YΪNԪ�ء�WΪSԪ�ء�MΪClԪ�أ�
��1��������������֪��WΪ��Ԫ�أ�Ԫ��ZΪ��Ԫ�أ������ڱ���λ���ǣ��������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��2��Ԫ��XΪ̼�������γɶ��ֵ��ʣ���������������Ʒֱ��ǣ����ʯ��ʯī������Ϊͬ�������壬
�ʴ�Ϊ�����ʯ��ʯī��ͬ�������壻
��3��YΪNԪ�أ����������Ļ�ѧʽΪN2O5������Ԫ�������������ˮ����������ǿ����HClO4��
�ʴ�Ϊ��N2O5��HClO4��
��4��Cl-���ӽṹʾ��ͼΪ ��X��M�γɻ�����ΪCCl4�������ʽΪ��
��X��M�γɻ�����ΪCCl4�������ʽΪ�� ��
��
�ʴ�Ϊ�� ��
�� ��
��
��5��ͬ�����������ԭ�Ӱ뾶��С�����Ӳ�Խ��ԭ�Ӱ뾶Խ����������Ԫ���а뾶��С��Ԫ�صķ�����NԪ�أ��ʴ�Ϊ��N��
��1��������������֪��WΪ��Ԫ�أ�Ԫ��ZΪ��Ԫ�أ������ڱ���λ���ǣ��������ڢ�A�壬
�ʴ�Ϊ���������ڢ�A�壻
��2��Ԫ��XΪ̼�������γɶ��ֵ��ʣ���������������Ʒֱ��ǣ����ʯ��ʯī������Ϊͬ�������壬
�ʴ�Ϊ�����ʯ��ʯī��ͬ�������壻
��3��YΪNԪ�أ����������Ļ�ѧʽΪN2O5������Ԫ�������������ˮ����������ǿ����HClO4��
�ʴ�Ϊ��N2O5��HClO4��
��4��Cl-���ӽṹʾ��ͼΪ
 ��X��M�γɻ�����ΪCCl4�������ʽΪ��
��X��M�γɻ�����ΪCCl4�������ʽΪ�� ��
���ʴ�Ϊ��
 ��
�� ��
����5��ͬ�����������ԭ�Ӱ뾶��С�����Ӳ�Խ��ԭ�Ӱ뾶Խ����������Ԫ���а뾶��С��Ԫ�صķ�����NԪ�أ��ʴ�Ϊ��N��
���������⿼��ṹ����λ�ù�ϵӦ�ã��ƶ�Ԫ���ǽ���ؼ������ضԻ���֪ʶ�Ŀ��飬�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
������һ�����ʵ���Ũ�ȵ�������Һʱ�����д��������ʹ��������ҺŨ��ƫ�ߵ��ǣ�������
| A��Ũ����ϡ�ͺ�����ת��������ƿ |
| B���ܽ����ʱ��Һ��ɽ� |
| C������ʱ��������ƿƿ���̶��� |
| D��ҡ�Ⱥ��Һ���½����ټ�ˮ���̶��� |
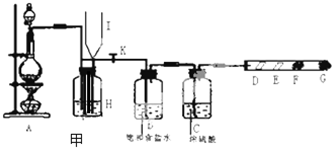

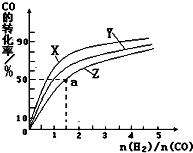 ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȣ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�
ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȣ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʣ�