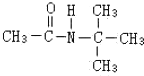题目内容
13.一定条件下,将34mL NO和O2混合气体充入试管中,并将试管倒立于水中,充分反应后剩余气体为6mL,则混合气体中NO与O2的体积分别为( )| A. | 22 mL、12 mL | B. | 13 mL、21 mL | C. | 16 mL、16 mL | D. | 21 mL、13 mL |
分析 NO和O2混合气体充入试管中,然后将试管倒立于水中,发生的反应为:4NO+3O2+2H2O=4HNO3,剩余的气体可能为氧气,也可能为NO,根据反应方程式进行讨论计算出混合气体中NO与O2的体积.
解答 解:发生的反应为:4NO+3O2+2H2O=4HNO3,
若剩余的6mL为NO时,则发生反应的NO和O2的总体积为:34mL-6mL=28mL,其中反应消耗NO为:28mL×$\frac{4}{7}$=16mL,消耗氧气为:28mL-16mL=12mL,则原混合气体中含有NO体积为:16mL+6mL=22mL,含有12mL氧气;
若剩余的6mL为氧气时,则发生反应的NO和O2的总体积为:34mL-6mL=28mL,其中反应消耗NO为:28mL×$\frac{4}{7}$=16mL,消耗氧气为:28mL-16mL=12mL,则原混合气体中含有NO体积为:16mL,含有氧气的体积为:6mL+12mL=18mL;
根据分析可知,正确的为A,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.下列事实与胶体性质无关的是( )
| A. | 自来水厂用含铁的化合物作净水剂 | |
| B. | 用丁达尔效应区分氢氧化铁胶体和氯化铁溶液 | |
| C. | 一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 | |
| D. | 在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
4.同温同压下,等质量的CO和CO2气体相比较,下列叙述中正确的是( )
| A. | 所含碳原子数比为1:1 | B. | 体积比为1:1 | ||
| C. | 密度比为7:11 | D. | 分子数比为7:11 |
5.中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM2.5的酸碱性,试样的pH=4.
将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-5 | 6×10-5 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
2. T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
(1)TY2是一种常用的溶剂,是非极性分子(填极性分子或非极性分子),分子中存在2个σ 键.W的最简单氢化物容易液化,理由是氟化氢分子之间存在着氢键.
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的第一电离能由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g/cm3,则晶胞边长为3.61×10-8cm;ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3杂.元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1mol Z参加反应有1mol电子发生转移.
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 Ni |
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的第一电离能由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g/cm3,则晶胞边长为3.61×10-8cm;ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3杂.元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1mol Z参加反应有1mol电子发生转移.
 根据图填空:
根据图填空: ,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.下图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)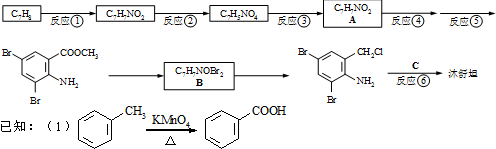
 +2
+2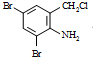 +K2CO3→2
+K2CO3→2 B
B
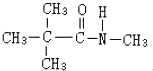 、
、