题目内容
现有两份溶液,一是质量分数24.5%,密度1.2g/mL的硫酸,二是200mL的混合溶液,其中H2SO4的浓度为0.5mol/L,Na2SO4的浓度为2.0mol/L,实验室需要浓度为1.0mol/LH2SO4,浓度为0.4mol/LNa2SO4的混合溶液,为配制所需溶液,回答下列问题:
(1)质量分数24.5%,密度1.2g/mL的硫酸浓度c(H2SO4)= mol/L
(2)原200mL的混合溶液中n(H2SO4)= mol n(Na2SO4)= mol
(3)为配制所需溶液,要质量分数24.5%,密度1.2g/mL的硫酸体积= mL.
(4)简述配制过程:①将200mL的混合溶液倒入大烧杯中,
②
③将烧杯中的溶液沿玻璃棒倒入 mL的容量瓶中,
④
⑤加水至离刻度线2-3cm处
⑥以下略.
(1)质量分数24.5%,密度1.2g/mL的硫酸浓度c(H2SO4)=
(2)原200mL的混合溶液中n(H2SO4)=
(3)为配制所需溶液,要质量分数24.5%,密度1.2g/mL的硫酸体积=
(4)简述配制过程:①将200mL的混合溶液倒入大烧杯中,
②
③将烧杯中的溶液沿玻璃棒倒入
④
⑤加水至离刻度线2-3cm处
⑥以下略.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)依据C=
计算质量分数24.5%,密度1.2g/mL的硫酸的物质的量浓度;
(2)依据n=CV计算解答;
(3)用200mL的混合溶液配制浓度为0.4mol/LNa2SO4的混合溶液,设配制溶液的体积为V,则依据稀释前后溶质的物质的量不变计算溶液的体积,计算需要质量分数24.5%,密度1.2g/mL的硫酸体积;
(4)依据配制一定物质的量浓度溶液的正确操作解答.
| 1000ρω |
| M |
(2)依据n=CV计算解答;
(3)用200mL的混合溶液配制浓度为0.4mol/LNa2SO4的混合溶液,设配制溶液的体积为V,则依据稀释前后溶质的物质的量不变计算溶液的体积,计算需要质量分数24.5%,密度1.2g/mL的硫酸体积;
(4)依据配制一定物质的量浓度溶液的正确操作解答.
解答:
解:(1)质量分数24.5%,密度1.2g/mL的硫酸的物质的量浓度C=
=3mol/L;
故答案为:3;
(2)原200mL的混合溶液中n(H2SO4)=CV=0.5mol/L×0.2L=0.1mol;
n(Na2SO4)=2.0mol/L×0.2L=0.4mol;
故答案为:0.1;0.4;
(3)用200mL的混合溶液配制浓度为0.4mol/LNa2SO4的混合溶液,设配制溶液的体积为V,则依据稀释前后溶质的物质的量不变,200ml×2.0mol/L=V×0.4mol/L,解得V=1000mL;
要配制浓度为1.0mol/LH2SO41000ml,设需要V′质量分数24.5%,密度1.2g/mL的硫酸,依据稀释前后溶质的物质的量不变,200mL×0.5mol/L+3mol/L×V′=1.0mol/L×1000ml,解得V′=300mL;
故答案为:300;
(4)②浓硫酸稀释的正确操作为:将浓硫酸沿着烧杯壁缓慢注入水中,并用玻璃棒不断搅拌,
故答案为:沿玻璃棒注入300ml质量分数24.5%,密度1.2g/mL的硫酸,并用玻璃棒不断搅拌;
③要配制1000ml溶液应选择1000ml容量瓶;
故答案为:1000;
④洗涤的正确操作为:用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液全部转移到容量瓶;
故答案为:用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液全部转移到容量瓶.
| 1000×1.2×24.5% |
| 98 |
故答案为:3;
(2)原200mL的混合溶液中n(H2SO4)=CV=0.5mol/L×0.2L=0.1mol;
n(Na2SO4)=2.0mol/L×0.2L=0.4mol;
故答案为:0.1;0.4;
(3)用200mL的混合溶液配制浓度为0.4mol/LNa2SO4的混合溶液,设配制溶液的体积为V,则依据稀释前后溶质的物质的量不变,200ml×2.0mol/L=V×0.4mol/L,解得V=1000mL;
要配制浓度为1.0mol/LH2SO41000ml,设需要V′质量分数24.5%,密度1.2g/mL的硫酸,依据稀释前后溶质的物质的量不变,200mL×0.5mol/L+3mol/L×V′=1.0mol/L×1000ml,解得V′=300mL;
故答案为:300;
(4)②浓硫酸稀释的正确操作为:将浓硫酸沿着烧杯壁缓慢注入水中,并用玻璃棒不断搅拌,
故答案为:沿玻璃棒注入300ml质量分数24.5%,密度1.2g/mL的硫酸,并用玻璃棒不断搅拌;
③要配制1000ml溶液应选择1000ml容量瓶;
故答案为:1000;
④洗涤的正确操作为:用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液全部转移到容量瓶;
故答案为:用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液全部转移到容量瓶.
点评:本题考查了配制一定物质的量浓度溶液,明确配制过程是解题关键,注意溶液体积的计算,题目难度中等.

练习册系列答案
相关题目
已知:C (s)+O2(g)=CO(g)△H=-110.50KJ/mol
C (s)+O2(g)=CO2(g)△H=-393.51KJ/mol
则反应C (s)+CO2(g)=2CO(g)的△H为( )
C (s)+O2(g)=CO2(g)△H=-393.51KJ/mol
则反应C (s)+CO2(g)=2CO(g)的△H为( )
| A、-283.01KJ/mol |
| B、+172.51 KJ/mol |
| C、+283.01KJ/mol |
| D、-504.01 KJ/mol |
欲除去下列物质中混入的少量杂质(括号内物质为杂质),错误的是( )
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
下列有关化学与生活说法中,正确的是( )
A、 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B、含有食品添加剂的食品对人体健康均有害,不宜食用 |
| C、硫、氮的氧化物会造成酸雨,酸雨指pH小于7的雨水 |
| D、明矾是常用的水处理剂,可用于城市自来水的杀菌消毒 |
下列说法不正确的是( )
| A、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B、水解反应NH4++H2O?NH3?H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C、制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D、盐类水解反应的逆反应是中和反应 |
实验室用下列两种方法制氯气:①用含HCl 4mol的浓盐酸与足量的MnO2反应;②用1mol MnO2与足量浓盐酸反应.所得的氯气( )
| A、①比②多 | B、②比①多 |
| C、一样多 | D、无法比较 |
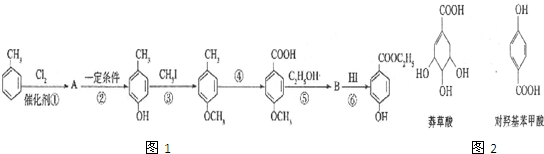
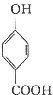 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式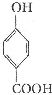 所有同分异构体的结构简式
所有同分异构体的结构简式