题目内容
17.某混合溶液中所含离子的浓度如下表所示,则M离子可能为( )| 所含离子 | Fe2+ | SO42- | H+ | M |
| 浓度(mol•L-1) | 1 | 1 | 2 | 2 |
| A. | Na+ | B. | Mg2+ | C. | Cl- | D. | CO32- |
分析 根据电解质混合溶液中阴阳离子所带电荷相等确定M离子所带电荷,并利用离子之间的反应来判断存在的离子,以此解答该题.
解答 解:溶液中,已知的阳离子所带电量为:1mol/L×2+2mol/L×1=4mol/L,阴离子所带总电量为:1mol/L×2=2mol/L,
由电荷守恒可知,溶液中还存在阴离子,已知阴离子浓度为2mol/L,则应带1个负电荷,题中只有C符合.
故选C.
点评 本题考查物质的量浓度的有关计算、离子共存,为高频考点,侧重考查学生的分析能力,难度不大,利用电荷守恒确定M所带电荷是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.对此反应下列说法中正确的是( )
| A. | 2 mol FeSO4发生反应时,反应中共有10 mol电子转移 | |
| B. | 每生成16g氧气就有1molFe2+被还原 | |
| C. | Na2O2只作氧化剂 | |
| D. | 氧化产物只有Na2FeO4 |
8.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(石墨)=C(金刚石)△H=1.9kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,则向含0.1mol/L的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | |
| D. | 2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 0.1 mol/L的NaHSO3溶液中含HSO3-的数目为0.1NA | |
| B. | 已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol,则将1 mol SO2与足量O2混合后充分反应放出的热量为98.3 kJ | |
| C. | 惰性电极电解硫酸铜的溶液,当阳极生成6.4 g铜时,阴极产生的气体在标准状况下为1.12 L | |
| D. | 金属发生吸氧腐蚀时,消耗1 mol O2,转移电子数为4NA |
12.下列推断不正确的是( )
| A. | 工业上可以用碳还原二氧化硅得到硅和二氧化碳 | |
| B. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| C. | Mg失火不能用CO2灭火;Na失火也不能用CO2灭火 | |
| D. | Fe与S直接化合生成FeS;Al与S也可以直接化合得到Al2S3 |
2.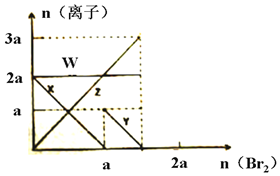 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )| A. | 离子的还原性I->Fe2+>Br- | |
| B. | 四条线与溶液中离子的对应关系是:X-Fe2+、Y-I-、Z-Br-、W-Cl- | |
| C. | 当4a=3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+)c:(Br-)=1:2:8 | |
| D. | 当3a≤2b时,发生的离子方程式:2Fe2++4I-+3Br2═2Fe3++2I2+6Br- |
9.除去下列物质中混有的杂质,选择试剂及操作都正确的一项是( )
| 选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
| A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
| B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
| C | CO2 | SO2 | 澄清石灰水 | 洗气 |
| D | I2 | NaCl | 酒精 | 萃取、分液 |
| A. | A | B. | B | C. | C | D. | D |
6.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂.
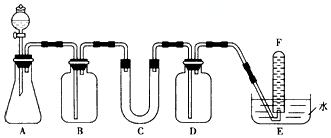
(1)A是实验室用石灰石制取CO2的装置.离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑.
(2)C中U型管内装的是Na2O2粉末,写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2NaCO3+O2.
(3)填写表中空格
(4)试管F中收集满气体后,检验该气体的方法是:取出试管,将带火星的木条伸入试管内,若木条复燃,说明该气体是O2.

(1)A是实验室用石灰石制取CO2的装置.离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑.
(2)C中U型管内装的是Na2O2粉末,写出过氧化钠与二氧化碳反应的化学方程式:2Na2O2+2CO2=2NaCO3+O2.
(3)填写表中空格
| 仪器 | 加入试剂 | 加入试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| D | 吸收过量CO2 | |
7.下列物质属于电解质的是( )
| A. | 三氧化硫 | B. | 干冰 | C. | 蔗糖溶液 | D. | 硫酸钡 |