题目内容
3.工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如图(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):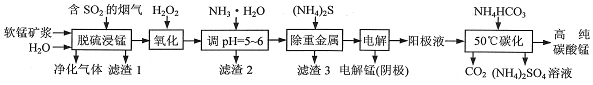
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为MnO2+SO2═MnSO4或H2O+SO2═H2SO3、MnO2+H2SO3═MnSO4+H2O.
(2)“滤渣2”中主要成分的化学式为Fe(OH)3、Al(OH)3.
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是Na2S会增大回收的(NH4)2SO4中Na+含量.
(4)“电解”时用惰性电极,阳极的电极反应式为2H2O-4e-═O2↑+4H+或4OH--4e-=O2↑+2H2O.
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为Mn2++2HCO3-$\frac{\underline{\;50℃\;}}{\;}$MnCO3↓+CO2↑+H2O.“50℃碳化”时加入过量NH4HCO3,可能的原因是为使MnSO4充分转化为MnCO3;NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失 (写两种).
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3•H2O)=1.75×10-5.在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O?NH3•H2O+H+,则该反应的平衡常数为5.7×10-10.
分析 “脱硫浸锰”环节:二氧化硫与软锰矿浆作用生成硫酸锰和少量的硫酸铝、硫酸亚铁等,二氧化硅不反应经过滤成为滤渣Ⅰ;
氧化环节:双氧水可将亚铁离子氧化为铁离子;加氨水调节溶液的PH=5~6把铁离子和铝离子转化为沉淀除去,则滤渣II为Fe(OH)3、Al(OH)3;加硫化铵把重金属转化为沉淀除去;通过电解得到金属锰;在阳极液中加碳酸氢铵得碳酸锰和硫酸铵等,据此分析解答.
解答 解:(1)“脱硫浸锰”主要产物为MnSO4,化学方程式为:MnO2+SO2═MnSO4或H2O+SO2═H2SO3、MnO2+H2SO3═MnSO4+H2O;
故答案为:MnO2+SO2═MnSO4或H2O+SO2═H2SO3、MnO2+H2SO3═MnSO4+H2O;
(2)由分析加氨水调节溶液的PH=5~6把铁离子和铝离子转化为沉淀除去,则滤渣II为Fe(OH)3、Al(OH)3;
故答案为:Fe(OH)3、Al(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 加Na2S会引入钠离子,增大回收的(NH4)2SO4中Na+含量;
故答案为:Na2S会增大回收的(NH4)2SO4中Na+含量;
(4)“电解”时用惰性电极,阳极发生氧化反应,应该是水电离出的氢氧根离子放电,电极反应式为 2H2O-4e-═O2↑+4H+或4OH--4e-=O2↑+2H2O;
故答案为:2H2O-4e-═O2↑+4H+或4OH--4e-=O2↑+2H2O;
(5))“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 Mn2++2HCO3-$\frac{\underline{\;50℃\;}}{\;}$MnCO3↓+CO2↑+H2O;
为使MnSO4充分转化为MnCO3; NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失,故“50℃碳化”时加入过量NH4HCO3;
故答案为:Mn2++2HCO3-$\frac{\underline{\;50℃\;}}{\;}$MnCO3↓+CO2↑+H2O;为使MnSO4充分转化为MnCO3; NH4HCO3受热易分解,造成损失;NH4HCO3能与H+反应,防止MnCO3沉淀溶解损失;
(6)25℃时,KW=1.0×10-14,Kb(NH3•H2O)=1.75×10-5,在(NH4)2SO4溶液中:NH4++H2O?NH3•H2O+H+,则该反应的平衡常数为$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$•$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{k}_{W}}{k(N{H}_{3}•{H}_{2}O)}$$\frac{1×1{0}^{-14}}{1.75×1{0}^{-5}}$=5.7×10-10;
故答案为:5.7×10-10.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、实验方案评价、氧化还原反应、水溶液中化学平衡常数的计算等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量,注意相关基础知识的学习与积累.

| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前3min的平均速率v(Z)=2.0×10-5 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(正)>v(逆) | |
| C. | 升高温度,该反应的平衡常数将增大 | |
| D. | 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 |
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸的电离:CH3COOH═CH3COO-+H+ | |
| C. | 碳酸钙的溶解平衡:CaCO3(s)?Ca2+(aq)+CO32-(aq) | |
| D. | H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol |
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚乙烯 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 氨气具有还原性,可用作制冷剂 | |
| C. | Na2O2呈浅黄色,可用作潜水艇中的供氧剂 | |
| D. | 明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂 |
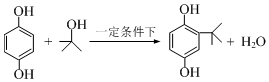
 2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下:
2-叔丁基对苯二酚是一种重要的食品抗氧剂,现以对苯二酚、叔丁醇为原料,一定条件下经Freidel-Crafts 烷基化反应合成.原理如下: