题目内容
5.实验室用浓盐酸与二氧化锰固体加热反应来制备氯气,某兴趣小组制取氯气并进行氯气的性质实验装置如图,请回答下列问题: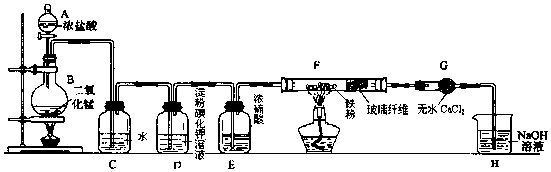
(1)仪器A的名称是分液漏斗.
(2)C中反应的化学方程式为Cl2+H2O=HCl+HClO,所得溶液除水分子外,还含有的分子和离子中正确的是C.
A.Cl2、HCl、HClO、H+、Cl- B.Cl2、Mn2+、HClO、H+、Cl-
C.Cl2、HClO、H+、Cl-、ClO- D.Cl2、HCl、HClO、H+、Mn2+
(3)实验中观察到D溶液变蓝色,写出D中发生反应的化学方程式为Cl2+2KI=I2+2KCl.
(4)F中氯气与铁粉反应制备无水三氯化铁,查资料知该化合物呈棕红色、易吸水潮解,100℃左右时升华.E中浓硫酸的作用是干燥氯气,双通管F中玻璃纤维(不参与反应)的作用是防止氯化铁堵塞后面的导管.
(5)H中盛有NaOH溶液,发生反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O.
分析 A中的浓盐酸与B中的二氧化锰在加热条件下反应生成氯气,氯气通入C水中生成HCl和HClO,氯气进入D中与KI反应生成单质碘,再进入E通过浓硫酸干燥,在F中与Fe反应生成氯化铁,G中干燥剂可以防止H中的水蒸气进入F中,最后H中NaOH溶液用于吸收多余的氯气;
(1)依据仪器形状说出其名称;
(2)氯气通入C水中生成HCl和HClO,根据HCl和HClO的电离分析;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘;生成的氯化铁易堵塞导管;
(4)制取的氯气中含有水蒸气,要得到干燥氯气,应除去氯气中的水蒸气;
(5)氯气有毒,要进行尾气处理;氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水
解答 解:(1)依据仪器形状可知:装置A盛放浓盐酸的为分液漏斗;
故答案为:分液漏斗;
(2)氯气通入C水中生成HCl和HClO,其反应的方程式为:Cl2+H2O=HCl+HClO;HCl在溶液中完全电离出H+、Cl-,HClO在溶液中部分电离出H+、ClO-,所以氯水中含有的微粒为Cl2、HClO、H+、Cl-、ClO-;
故答案为:Cl2+H2O=HCl+HClO;C;
(3)氯气具有强的氧化性,能够氧化碘化钾生成单质碘,反应方程式:Cl2+2KI=I2+2KCl,碘遇到淀粉变蓝;
故答案为:Cl2+2KI=I2+2KCl;
(3)制取的氯气中含有水蒸气,Fe与干燥的氯气反应,要得到干燥氯气,应除去氯气中的水蒸气,浓硫酸具有吸水性,能够干燥氯气;生成的氯化铁易堵塞导管,双通管F中加玻璃纤维可以防止氯化铁进入后面的导管,引起导管堵塞;
故答案为:干燥氯气;防止氯化铁堵塞后面的导管;
(4)氯气有毒,要进行尾气处理,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收尾气中的氯气;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了氯气的实验室制备和性质检验,熟悉氯气制备原理及氯气的化学性质是解题关键,题目难度中等,侧重于考查学生的分析能力、实验探究能力和对基础知识的应用能力.

| A. | 铜 | B. | 生理盐水 | C. | 氢氧化钠 | D. | 乙醇 |
| A. | 负极反应Al-3e-=Al3+ | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 海水中的 OH ? 向正极移动 |
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚乙烯 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |

 ≡O$\stackrel{HCN}{→}$
≡O$\stackrel{HCN}{→}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$
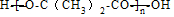 +(n-1)H2O.
+(n-1)H2O.
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: